Verdejo-Iáñez, Alejandro ¹; Hinojosa-Medina, Yolanda ¹; Galisteo-Vela, Amalia ¹*
1 Facultad de Medicina de la Universidad de Granada
* Autor de correspondencia: amaliagalisteovela@gmail.com
Resumen
Introducción/Objetivos
Evaluar la aparición de efectos adversos a corto plazo y los factores de riesgo tras recibir la vacuna BNT162b2 en el personal sanitario del Hospital Clínico San Cecilio de Granada.
Material y Métodos
Estudio observacional, longitudinal, con sentido hacia delante y prospectivo en el que se analizaron las historias clínicas de 1492 profesionales sanitarios que notificaron reacciones adversas en el periodo comprendido entre el 27 de diciembre de 2020 y el 1 de septiembre de 2021. Se aplicaron test T de Student y chi-cuadrado para buscar asociación con la edad, sexo, dosis completa e infección previa por COVID-19. Finalmente, se realizó un análisis multivariante de regresión logística para analizar el efecto de las asociaciones ajustadas por posibles factores de confusión.
Resultados
Solo el 3.8% de los participantes presentaron alguna reacción adversa. Las más frecuentes fueron malestar general (2.2%), fiebre (1.9%) y artromialgias (1.8%). No se encontró asociación entre presentar reacción adversa y la edad, el sexo o la categoría MIR/EIR. Por el contrario, sí se encontró asociación, de acuerdo con el modelo de regresión logística ajustado, entre reacción adversa y la categoría enfermería (OR = 2.59, IC95%: 1.29 – 5.69), la pauta completa (OR = 0.11, IC95%: 0.02 – 0.77) y la infección COVID-19 previa (OR = 2.22, IC95%: 1.15 – 4.06).
Conclusiones
La frecuencia de efectos adversos fue reducida entre el personal sanitario. La infección previa y ser enfermero se relacionaron con mayor riesgo de notificar reacción adversa. Los efectos adversos que se notificaron fueron leves, lo que apoya el uso de la vacuna BNT162b2 ante posibles dosis de refuerzo a este colectivo. Aun así, es necesario seguir evaluando la seguridad de esta vacuna y realizar más estudios.
Palabras clave: reacciones adversas, personal sanitario, BNT162b2, COVID-19, SARS-CoV-2, vacunación.
Keywords: adverse reactions, health personnel, BNT162b2, COVID-19, SARS-CoV-2, vaccination.
1. Introducción
A finales de 2019 apareció el coronavirus SARS-CoV-2 causante de la enfermedad COVID-19, que fue declarada pandemia el 11 de marzo de 2020 por la OMS (1). La COVID-19 generó mucha incertidumbre. El cuadro clínico de presentación de este síndrome es muy variado. Los casos notificados pueden ser asintomáticos o presentar una sintomatología que abarca desde fiebre, tos seca, cansancio o, en menor medida, ageusia, anosmia, mialgias, diarreas, erupciones cutáneas, etc. y los que tienen peor suerte, mueren, por ejemplo, por el síndrome del distrés respiratorio del adulto (SDRA) o por complicaciones de sus comorbilidades (2,3). Se ha visto que, una vez combatida la infección, las personas pueden sentirse fatigadas o tener dificultades para dormir, entre otros (4). Estas secuelas se reúnen bajo el término Long COVID o COVID persistente (5).
La gravedad de la infección, junto a su gran velocidad de transmisión, provocaron la urgente necesidad de combatir el virus dada la falta de tratamientos eficaces para tratar la enfermedad. Una de las estrategias empleada fue el uso de vacunas con las que inmunizar a la población frente a este virus, hecho que supuso un gran reto biotecnológico. Entre las diferentes opciones, la vacuna de ARNm de Pfizer BNT162b2 (Comirnaty ®) fue la primera aprobada para su uso de emergencia por la Agencia Europea del Medicamento, el 21 de diciembre de 2020 (6), suceso que ha cuestionado su seguridad, ya que se ha desarrollado en un periodo de tiempo muy corto respecto a otras vacunas. Desde entonces, se ha administrado un número considerable de dosis de la misma, concretamente, en Europa, unos 594 millones de dosis (7).
La evidencia científica muestra que la vacunación contra la COVID-19 es efectiva (8–10). Sin embargo, no está exenta de riesgo y efectos adversos. La información actual indica que los beneficios superan los riesgos (11). Aun así, es importante monitorizar en tiempo real los efectos que esta vacuna pueda producir y que no se hayan detectado en estudios previos. Debido a que el profesional sanitario está más expuesto al virus y ante la posibilidad de que haya que administrar varias dosis de refuerzo de la vacuna, surge la siguiente pregunta: ¿es lo suficientemente segura o, por el contrario, habría que optar por otro tipo de vacuna con menos efectos adversos?
Por ello, el objetivo de este estudio fue evaluar la aparición de efectos adversos a corto plazo y los factores de riesgo tras la administración de la vacuna BNT162b2 en el personal sanitario del Hospital Clínico San Cecilio de Granada entre el 27 de diciembre de 2020 (fecha en que llegó la primera vacuna a Granada) y el 1 de septiembre de 2021.
2. Material y Métodos
2.1. Diseño del estudio
Se trata de un estudio observacional, longitudinal, con sentido hacia delante y prospectivo realizado al personal sanitario del Hospital Clínico San Cecilio de Granada entre el 27 de diciembre de 2020 (fecha en que llegó la primera vacuna a Granada) y el 1 de septiembre de 2021.
2.2. Fuentes de información
Se accedió a las historias clínicas digitalizadas de un total de 1497 sanitarios que accedieron voluntariamente a vacunarse y participar en el estudio. El acceso se realizó mediante el módulo de vacunas de Diraya ®. Con esa información se elaboró la base de datos utilizada. Los datos de cinco participantes se eliminaron, dado que se hizo un registro incorrecto.
Las variables estudiadas fueron edad, sexo, categoría profesional (medicina, MIR/EIR, enfermería), pauta completa de vacunación, reacción adversa a la vacuna (fiebre, malestar general, adenopatías, artromialgias, reacción local intensa, cefalea, náuseas, diarrea, reacción adversa dermatológica) y antecedentes de infección por COVID-19 confirmada.
El rango de edad del personal sanitario estuvo entre los 20 y 70 años. La pauta completa indica que la persona ha recibido las dos dosis o solo una en caso de haber sufrido la infección previamente.
2.3. Análisis estadístico
Se realizó un análisis descriptivo univariante con el objetivo de resumir las características de la muestra del estudio. Para la variable “edad” se calculó la media y desviación estándar; mientras que, para el resto de variables, por ser cualitativas, se calculó la frecuencia. Por otro lado, se realizó un análisis bivariante con el que comprobar la posible asociación entre sufrir alguna reacción adversa tras la vacunación y el resto de variables medidas. En esta ocasión se realizó el test T de Student para la variable “edad” y el test chi-cuadrado para las demás. La asociación se expresó con el valor p, considerando significativos los valores de p < 0.050.
Por último, para analizar la influencia de potenciales factores de confusión en la asociación entre presentar reacción adversa a la vacuna y cada una de las variables, se realizó un análisis multivariante. Al ser nuestro desenlace (reacción adversa a la vacuna) una variable cualitativa y dicotómica, este análisis consistió en una regresión logística. Edad, sexo, categoría profesional (medicina, MIR/EIR, enfermería), pauta completa de vacunación y haber pasado la infección previamente fueron las covariables utilizadas. La asociación se expresó con el valor p y como Odds Ratio (OR) con un intervalo de confianza al 95%.
Todos estos análisis fueron realizados con el Software estadístico R (versión 4.1.2), mediante el paquete R Commander. También se utilizó el software IBM SPSS ®, versión 26, a la que se accedió mediante nuestra institución, la Universidad de Granada.
2.4. Consideraciones éticas
Se cumplieron los requisitos establecidos por la Declaración de Helsinki para la investigación con datos humanos. El equipo de investigación empleó una base de datos anónima para realizar los análisis. No se utilizaron variables potencialmente identificables. Se obtuvo el consentimiento verbal de los participantes, ya que los únicos datos utilizados procedían de una base de datos anonimizada. El protocolo del estudio fue aprobado por el Comité Provincial de Ética en Investigación de Granada (12).
3. Resultados
Se seleccionaron 1492 trabajadores sanitarios cuyas características se resumieron en la Tabla 1. La edad media de la muestra fue de 43.8 años (desviación estándar: 12.6). Se registraron datos de 1078 mujeres (72.3%) y 413 hombres (27.7%). De las tres categorías profesionales representadas, la predominante fue enfermería (55.9%), seguida de medicina (33%) y MIR/EIR (11.1%). Un total de 1483 participantes (99.5%) recibieron la pauta completa de vacunación y 220 participantes (14.8%) tenían antecedentes de infección por COVID-19. Solo 56 participantes (3.8%) tuvieron alguna reacción adversa. Las más frecuentes fueron malestar general (2.2%), fiebre (1.9%) y artromialgias (1.8%) (Tabla 1; Figura 1).
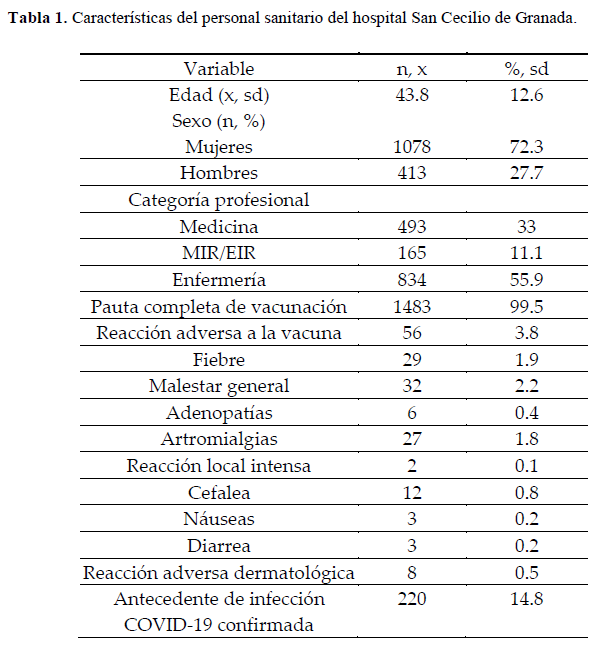
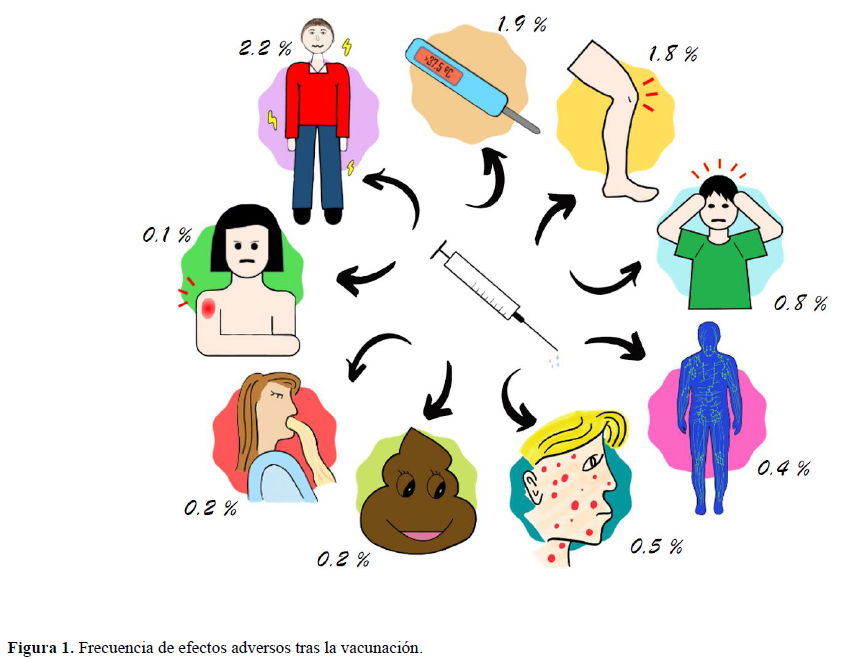
En la Tabla 2 se recogieron los factores relacionados con padecer alguna reacción adversa. Para las variables edad, sexo o categoría MIR/EIR no se encontró asociación significativa con padecer alguna reacción adversa (p > 0.050). El resto de variables sí la presentaron, de manera que los médicos tuvieron menos riesgo de notificar reacción adversa (p = 0.014), aquellos con pauta completa de vacunación tuvieron menos riesgo (p = 0.001), los enfermeros tuvieron más riesgo (p = 0.003) y los que tuvieron antecedentes de infección previa tuvieron más riesgo (p = 0.010).
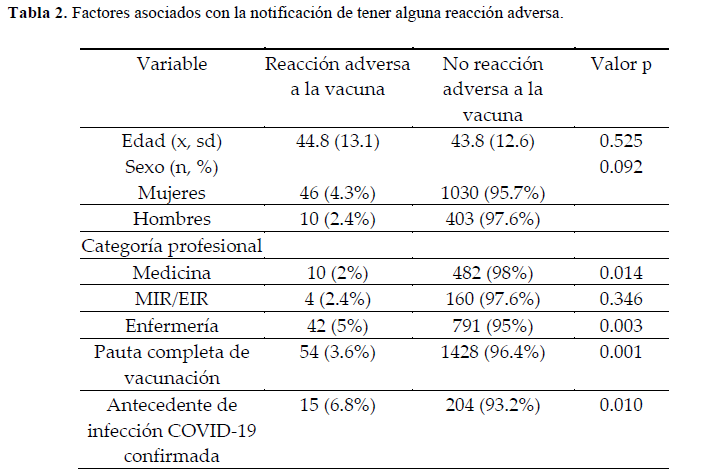
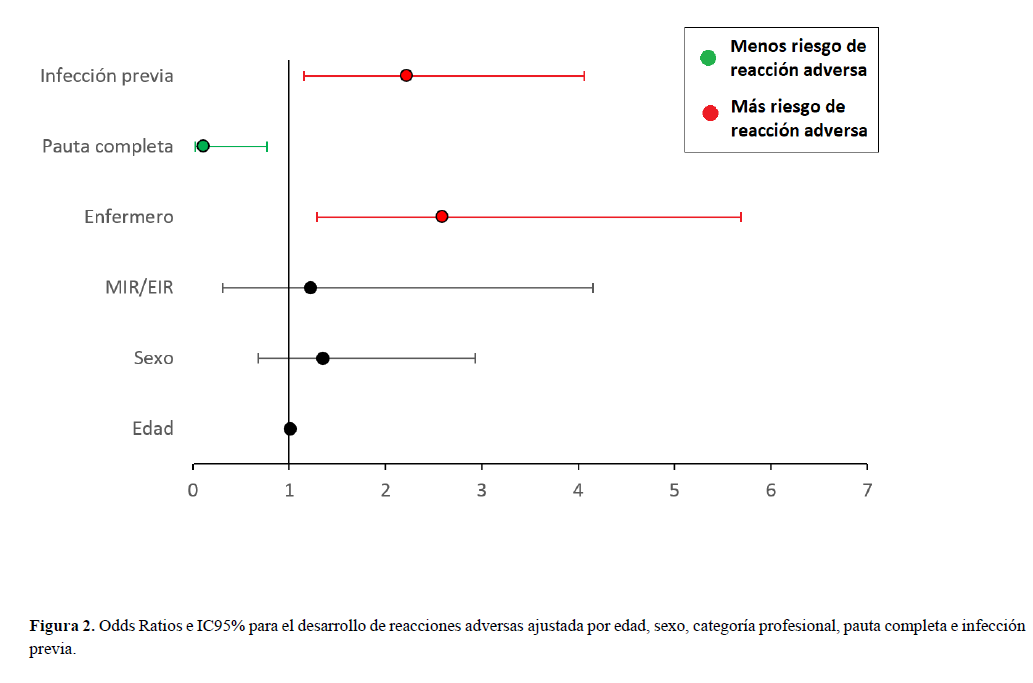
Los resultados del análisis multivariante de regresión logística ajustado para edad, sexo, categoría profesional, pauta completa e infección previa se recogieron en la Tabla 3. No se obtuvo significación estadística, para edad, sexo ni categoría MIR/EIR. Para la categoría enfermería, la OR fue 2.59 (IC al 95%, 1.29 – 5.69); para la pauta completa, la OR fue 0.11 (IC al 95%, 0.02 – 0.77); y para infección previa, la OR fue 2.22 (IC al 95%, 1.15 – 4.06) (Figura 2).
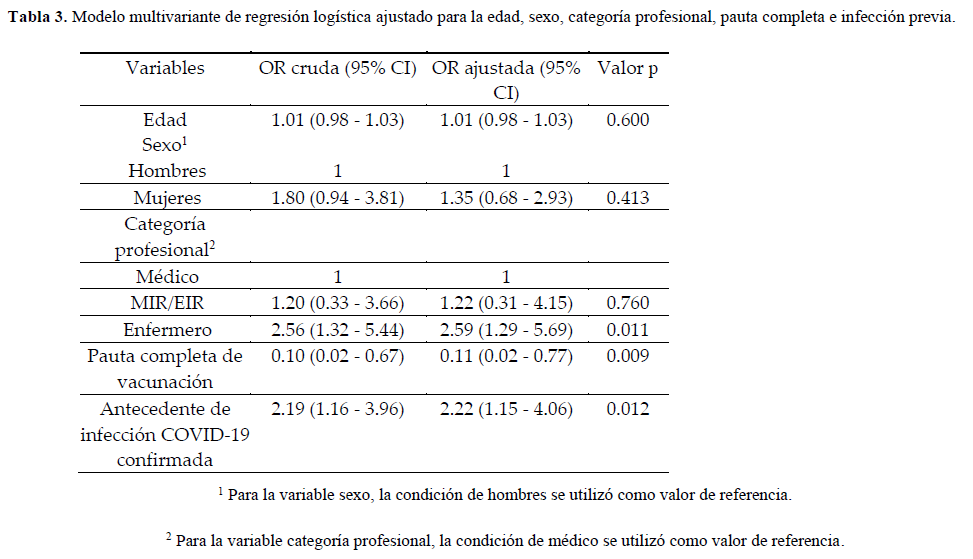
4. Discusión
En este estudio se encontró que la frecuencia de presentación de reacciones adversas en el personal sanitario fue de 3.8%, principalmente malestar general (2.2%), fiebre (1.9%) y artromialgias (1.8%). No obstante, ese porcentaje de reacciones adversas fue relativamente inferior al señalado por otros artículos. La prevalencia de efectos adversos fue más reducida porque los datos se obtuvieron de historias clínicas y no se recogieron las reacciones adversas más leves y comunes que registraron otros estudios. Además, puede que la población de este estudio, por su profesión, fuese más consciente de los efectos adversos comunes de la vacunación y por ello los notifican menos (8,10,13).
Una vez ajustada la variable reacción adversa para edad, sexo, categoría profesional, pauta completa y antecedentes de infección, no se identificó ningún factor de confusión.
No se encontró asociación entre edad ni sexo con la notificación de más reacciones adversas. Este hecho coincidió con el hallazgo de Dziedzic et al. (14), que examinaron los efectos adversos de la vacunación en sanitarios y estudiantes de medicina: vieron que no había diferencias estadísticamente significativas entre hombres y mujeres, y tampoco entre edades, para desarrollar efectos adversos locales; sin embargo, en el caso de los sistémicos, detectaron que la población inferior a 29 años fue más propensa a desarrollarlos. Por otro lado, Menni et al. (13), encontraron asociación significativa entre ser menor de 55 años y notificar más efectos secundarios sistémicos; además, encontraron asociación entre ser mujer e informar de efectos secundarios locales; estas diferencias podrían deberse a las características de la población estudiada, no restringida al ámbito sanitario.
Dentro de la variable categoría profesional, los enfermeros reportaron más reacciones adversas que los médicos, OR = 2.59 (IC al 95%, 1.29 – 5.69). Esto podría deberse a que los médicos tienden a infranotificar las reacciones adversas.
Los profesionales con pauta completa de vacunación tuvieron menos reacciones adversas, OR = 0.11 (IC al 95%, 0.02 – 0.77). Esto se contradice con otros artículos que muestran que la segunda dosis produce más reacciones sistémicas (8,10,13). Una posible explicación es que las personas susceptibles a experimentar más efectos adversos, tras sufrirlos con la primera dosis, decidieron no recibir la segunda. Sin embargo, aquellos menos susceptibles experimentaron menor reacción adversa y decidieron administrarse la 2ª dosis. Esto podría sesgar los datos aparentando que tener la pauta completa provocase menos efectos adversos.
Finalmente, los que padecieron previamente la infección notificaron más reacciones adversas, OR = 2.22 (IC al 95%, 1.15 – 4.06). Esto es coherente con otras investigaciones (15–19) que mostraron que la inmunidad generada previamente por la infección podría provocar una reacción más intensa a la vacunación por la memoria inmunológica. Esto puede ayudar a establecer un protocolo de vacunación más adecuado en aquellos que hayan pasado ya la enfermedad.
Este estudio tiene varias limitaciones. No se registraron efectos adversos a largo plazo, en parte porque el tiempo de seguimiento fue distinto de unos participantes a otros. No se validó el modelo de regresión logística. Al ser un estudio unicéntrico, con una población muy concreta, se dificulta la extrapolación de resultados. La notificación de las reacciones adversas a la vacuna fue subjetiva, puesto que dependía de la propia persona.
Las fortalezas de este estudio son su diseño observacional, longitudinal, prospectivo y hacia delante al igual que su abordaje sobre un tema de actualidad e interés general, respecto al cual, se han hecho pocos estudios exclusivamente en el personal sanitario. Así mismo, contó con un considerable tamaño muestral que representó casi la totalidad del personal sanitario de un hospital. Además, se realizó un modelo de regresión logística para detectar factores de confusión.
5. Conclusiones
La frecuencia de efectos adversos fue reducida entre el personal sanitario. La infección previa y ser enfermero se relacionaron con mayor riesgo de notificar reacción adversa. Los efectos adversos que se notificaron fueron leves, lo que apoya el uso de la vacuna BNT162b2 ante posibles dosis de refuerzo a este colectivo. Aun así, es necesario seguir evaluando la seguridad de esta vacuna y realizar más estudios en este ámbito.
Declaraciones
Agradecimientos
Agradecemos al curso “Producción y Traducción de Artículos Biomédicos” (IV ed.) por la oportunidad que nos han dado. En especial a Mario Rivera Izquierdo por su ayuda y dedicación con nuestro grupo.
Conflictos de interés
Los autores declaran no tener ningún conflicto de interés.
Financiación
Ninguna
Referencias
1. WHO Director-General’s opening remarks at the media briefing on COVID-19 – 11 March 2020 [Internet]. Disponible en: https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020.
2. Hu B, Guo H, Zhou P, Shi Z-L. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol. 2020;1-14.
3. Coronavirus disease (COVID-19) [Internet]. Disponible en: https://www.who.int/news-room/questions-and-answers/item/coronavirus-disease-covid-19
4. Huang C, Huang L, Wang Y, Li X, Ren L, Gu X, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220-32.
5. Ministerio de Sanidad – Profesionales – Información científico-técnica, enfermedad por coronavirus, COVID-19 [Internet]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/ITCoronavirus/home.htm
6. EMA. Comirnaty [Internet]. European Medicines Agency. 2020. Disponible en: https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
7. COVID-19 vaccine doses administered by manufacturer, European Union [Internet]. Disponible en: https://ourworldindata.org/grapher/covid-vaccine-doses-by-manufacturer?country=~European+Union
8. Thomas SJ, Moreira ED, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months. N Engl J Med. 2021;385(19):1761-73.
9. Tartof SY, Slezak JM, Fischer H, Hong V, Ackerson BK, Ranasinghe ON, et al. Effectiveness of mRNA BNT162b2 COVID-19 vaccine up to 6 months in a large integrated health system in the USA: a retrospective cohort study. Lancet. 2021;398(10309):1407-16.
10. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603-15.
11. Lee GM. The Importance of Context in Covid-19 Vaccine Safety. N Engl J Med. 2021;385(12):1138-40.
12. Rivera-Izquierdo M, Soler-Iborte E, de Rojas JP, Pegalajar-García MD, Gil-Villalba A, Ruiz-Villaverde R, et al. Factors Associated with Adverse Reactions to BNT162b2 COVID-19 Vaccine in a Cohort of 3969 Hospital Workers. Vaccines (Basel). 2021;10(1):15.
13. Menni C, Klaser K, May A, Polidori L, Capdevila J, Louca P, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021;21(7):939-49.
14. Dziedzic A, Riad A, Attia S, Klugar M, Tanasiewicz M. Self-Reported Adverse Events of COVID-19 Vaccines in Polish Healthcare Workers and Medical Students. Cross-Sectional Study and Pooled Analysis of CoVaST Project Results in Central Europe. JCM. 2021;10(22):5338.
15. Raw RK, Rees J, Kelly CA, Wroe C, Chadwick DR. Prior COVID-19 infection is associated with increased Adverse Events (AEs) after the first, but not the second, dose of the BNT162b2/Pfizer vaccine. Vaccine. 2022;40(3):418-23.
16. d’Arminio Monforte A, Tavelli A, Perrone PM, Za A, Razzini K, Tomasoni D, et al. Association between previous infection with SARS CoV-2 and the risk of self-reported symptoms after mRNA BNT162b2 vaccination: Data from 3,078 health care workers. EClinicalMedicine. 2021;36:100914.
17. Li LL, Zheng C, La J, Do NV, Monach PA, Strymish JM, et al. Impact of prior SARS-CoV-2 infection on incidence of hospitalization and adverse events following mRNA SARS-CoV-2 vaccination: A nationwide, retrospective cohort study. Vaccine. 2022;40(8):1082-9.
18. Efrati S, Catalogna M, Abu Hamad R, Hadanny A, Bar-Chaim A, Benveniste-Levkovitz P, et al. Safety and humoral responses to BNT162b2 mRNA vaccination of SARS-CoV-2 previously infected and naive populations. Sci Rep. 2021;11(1):16543.
19. Klugar M, Riad A, Mekhemar M, Conrad J, Buchbender M, Howaldt H-P, et al. Side Effects of mRNA-Based and Viral Vector-Based COVID-19 Vaccines among German Healthcare Workers. Biology. 2021;10(8):752.
AMU 2022. Volumen 4, Número 1
Fecha de envío: Fecha de aceptación: Fecha de publicación:
23/03/2022 04/04/2022 31/05/2022
Cita el artículo: Verdejo-Iáñez A, Hinojosa-Medina Y, Galisteo-Vela A. Vacuna BNT162b2 en el personal sanitario: ¿Qué posibilidad hay de desarrollar efectos adversos? AMU. 2022; 4(1): 30-39
