González-Blanco, Inés¹ ²; Jiménez-González, Sonia¹ ² *; Montoro-Martín, Jesús¹
¹ Facultad de Medicina de la Universidad de Granada
² Academia de Alumnos Internos de la UGR
* Autor de correspondencia: jimenezglezsonia@gmail.com
Resumen
Introducción
Para el estadiaje de los gliomas cerebrales es importante el estado del gen IDH (“isocitrato deshidrogenasa”). El parámetro de perfusión rCBV/nCBV (“cerebral blood volume relative or normalized”) medido en la resonancia magnética con contraste de susceptibilidad dinámica (RM-DSC) se plantea como una técnica diagnóstica no invasiva frente a la biopsia cerebral para determinar su estado. El objetivo de este estudio fue analizar los beneficios en términos de validez diagnóstica que supone el uso de CBV medio obtenido en RM-DSC.
Material y Métodos
Esta revisión sistemática se realizó siguiendo la guía PRISMA. Se buscaron estudios publicados hasta marzo de 2025 en PubMed, Web Of Science y Scopus. Se seleccionaron 11 artículos observacionales para la revisión. Los criterios de inclusión fueron: la utilización de RM-DSC, la determinación de rCBV/nCBV medio y la determinación molecular del gen IDH. Se utilizó el QUADAS-2 como escala del riesgo de sesgo entre estudios.
Resultados
Todos los artículos plantearon la utilidad de la variable CBV en RM-DSC para el estudio de la mutación del gen IDH. Además, encontraron valores de CBV medio mayores en gliomas IDH wildtype, con un rango que oscila entre 0,83 y 9,21. Se encontraron numerosas diferencias en variables relacionadas con los parámetros de adquisición y posprocesamiento de las imágenes de RM.
Conclusiones
Se ha observado una relación entre el parámetro de perfusión CBV medio en RM-DSC y su utilidad como marcador en la determinación del estado del gen IDH.
Palabras clave: RM-DSC, gliomas, IDH, RM, DSC, CBV.
Abstract
Introduction
For the staging of brain gliomas, the status of the IDH (isocitrate dehydrogenase) gene is crucial. The perfusion parameter rCBV/nCBV (relative or normalized cerebral blood volume) measured using dynamic susceptibility contrast-enhanced magnetic resonance imaging (DSC-MRI) is proposed as a non-invasive diagnostic technique to assess the gene status, offering an alternative to brain biopsy. The aim of this study was to analyze the diagnostic validity of using mean CBV values obtained from DSC-MRI.
Material and Methods
This systematic review was conducted following the PRISMA guidelines. We searched for studies published up to March 2025 in PubMed, Web of Science, and Scopus. A total of eleven observational studies were selected for the review. The inclusion criteria were as follows: use of MRI-DSC, determination of mean rCBV/nCBV, and molecular analysis of the IDH gene. The QUADAS-2 tool was used to assess the risk of bias across studies.
Results
All studies suggested the usefulness of the CBV variable in MRI-DSC for studying the IDH gene mutation. Moreover, higher mean CBV values were observed in IDH wild-type gliomas, ranging from 0.83 to 9.21. Significant variations were found in variables related to MRI image acquisition and post-processing parameters.
Conclusions
A relationship was observed between the mean CBV perfusion parameter in DSC-MRI and its potential as a marker in gliomas with IDH mutations.
Keywords: DSC-MR, gliomas, IDH, MRI, DSC, CBV
1. Introducción
Los gliomas constituyen el tumor primario cerebral más común y son fruto de mutaciones en las células madre o progenitoras neuronales de la estirpe glial (1). La clasificación de este grupo de tumores en los distintos tipos fue cambiada en 2016 por la \textit{World Health Organization} (WHO). Dicha clasificación implementó la determinación de las características moleculares de los gliomas incluyendo en sus características diferenciales el estudio del gen de la isocitrato deshidrogenasa (IDH), así como otras mutaciones como la codeleción 1p19q, y se ha mantenido esta clasificación (1–4). Su mutación es de vital importancia ya que bloquea la diferenciación celular normal y promueve la oncogénesis a través de la producción de D-2-hidroxiglutarato (5). Este metabolito anormal inhibe la expresión de genes reparadores del ADN, lo que justifica que los gliomas con IDH-mutado tengan un pronóstico más favorable, pues el D-2-hidroxiglutarato le confiere una mayor quimiosensibilidad (6,7). Por tanto, la determinación del estado del gen IDH es fundamental para establecer la clasificación tumoral, así como su estrategia terapéutica. Además, podría permitir esclarecer con relativa precisión el pronóstico de la enfermedad (8).
Clásicamente, la biopsia cerebral ha sido el método de elección para la secuenciación del gen IDH (9). Sin embargo, la presencia de complicaciones asociadas como las hemorragias intracerebrales asintomáticas, déficit neurológico, crisis convulsivas y pérdida de conciencia, plantean la necesidad de hallar otras vías diagnósticas menos invasivas (10,11). Es por esto, que el avance tecnológico de las pruebas de imagen ha permitido que la resonancia magnética (RM) se plantee como una técnica diagnóstica que permita el estudio del gen IDH (8).
Se han estudiado distintas modalidades de RM para determinar la presencia de mutaciones en gliomas. Dentro de las posibles modalidades de RM existentes, se encuentra la RM con contraste de susceptibilidad dinámica (DSC, por sus siglas en inglés) (12). La RM-DSC permite valorar la microvasculatura cerebral por medio de los cambios de señal obtenidos del paso intravascular de un contraste, generalmente gadolinio (12,13). Además, la RM-DSC permite evaluar determinados parámetros hemodinámicos de perfusión cerebral tales como el volumen sanguíneo cerebral medio (CBV, por sus siglas en inglés) que cuantifica la cantidad de sangre en un determinado volumen de tejido cerebral(12,14,15). Al tratarse de un tema en auge y cuya evidencia disponible aumenta exponencialmente, es imperativo el estudio de la evidencia publicada hasta la fecha mediante nuevas revisiones sistemáticas y metaanálisis. En consecuencia, es necesario recopilar y contrastar la información disponible para determinar la posible utilidad de la RM-DSC. Particularmente, la variable rCBV (CBV relativo) a la hora de caracterizar el estado del gen IDH en gliomas.
El objetivo de esta revisión sistemática fue recopilar la información más reciente para analizar la posible ventaja diagnóstica que supone el uso de CBV en RM-DSC para la categorización de los distintos subtipos de gliomas, concretamente para la determinación del estado del gen IDH.
2. Material y Métodos
Esta revisión sistemática se realizó siguiendo la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (16). A su vez, fue presentada para su registro en la base de datos de recogida de revisiones sistemáticas llamada “OSF” (Open Society Foundations) (DOI 10.17605/OSF.IO/7TRKW), que se trata de un software gratuito de código abierto que facilita la colaboración en la investigación científica.
2.1. Estrategia de búsqueda
La pregunta de investigación fue: “¿Cuál es la utilidad del CBV en RM-DSC para la predicción del estado del gen IDH en gliomas cerebrales?”, detallada siguiendo la estrategia PICOS correspondiente a la Tabla 1. La búsqueda bibliográfica se realizó en las bases de datos de Medline (a través del buscador Pubmed), Web Of Science y Scopus. La ecuación de búsqueda utilizada fue: “Glioma AND Isocitrate Dehydrogenase AND Magnetic Resonance Imaging AND Cerebral Blood Volume”. La búsqueda de los artículos incluyó aquellos publicados hasta el 7 de marzo de 2025. Además, se empleó el filtro temporal de los 10 últimos años.
Tabla 1. Estrategia PICOS
| Categoría | Criterios de inclusión | Criterios de exclusión |
| Población | Pacientes con glioma cerebral con determinación molecular del gen IDH. | Pacientes con glioma cerebral sin determinación histológica del gen IDH. |
| Intervención | Parámetros de perfusión por RM-DSC usando la variable CBV, expresada en media. | Utilización de otra expresión numérica de la variable CBV, como la mediana. |
| Control | Diferencias de valores de rCBV/nCBV media en gliomas IDH-mutado e IDH-wildtype. | No comparación de los valores rCBV/nCBV media entre los gliomas IDH-mutado e IDH-wildtype. |
| Outcome | Determinación del estado del gen IDH por medio de la variable CBV. | Utilización únicamente de otras variables de perfusión para la determinación del estado del gen IDH. |
| Tipo de estudio | Estudios observacionales |
Casos clínicos Revisiones sistemáticas Metaanálisis |
2.2. Criterios de elegibilidad
Los criterios para la selección de los artículos fueron: (a) pruebas de imagen realizadas con RM-DSC, (b) medición del CBV relativo o normalizado; (c) expresión del valor en media (d) valoración de este parámetro en al menos dos grupos de pacientes con glioma, siendo uno de estos IDH-mutado y el otro IDH-wildtype.
Se excluyeron todos los artículos que tratasen otras variables sin tener en consideración los valores de volumen sanguíneo cerebral relativo (rCBV, por sus siglas en inglés) o volumen sanguíneo cerebral normalizado (nCBV, por sus siglas en inglés) expresados en media, y aquellos que no estudiaron el estado del gen IDH de forma aislada. Aquellos estudios en los que se valoraban variables con fines radiómicos o genómicos, así como aquellos centrados en el campo de las “-ómicas”. Asimismo, se excluyeron estudios que incluyesen aspectos relacionados con la inteligencia artificial para realizar el procesamiento de las imágenes y aquellos con RM-DSC diferente a 1,5-3 T. Finalmente, se excluyeron aquellos estudios relacionados únicamente con la vascularización, los que utilizaban un modelo no humano, aquello que no valoraban el diagnóstico del estado del gen IDH y que fueran metaanálisis o revisiones sistemáticas. Tras aplicar los criterios de selección, se añadió un artículo por búsqueda inversa (17).
2.3. Selección de estudios y extracción de datos
Los artículos fueron cribados en primera instancia, aplicando los criterios de inclusión y exclusión, en el título y abstract. Para este primer filtro los pares fueron GBI y MMJ. Posteriormente, se realizó un segundo cribado mediante la lectura completa del artículo de aquellos que no fueron excluidos, para lo que fueron los investigadores JGS y MMJ. En ambos procesos se realizó una revisión por pares de forma ciega y en caso de que hubiere discrepancias, se resolvieron mediante la revisión de un tercer investigador independiente.
Se extrajo información referente al tipo y diseño de estudio, muestra, intervención, comparación, resultado de interés, valor p correspondiente y resultado principal. Nuestras variables de interés fueron: rCBV o nCBV media y además se recogieron otras variables como: campo magnético utilizado, parámetros de adquisición, (tiempo de repetición (TR), tiempo de eco (TE) y ángulo de inclinación (FA = flip angle)) y el software utilizado para el procesamiento de las imágenes.
2.4. Evaluación de la calidad de los estudios
La calidad de los artículos se evaluó mediante una revisión por pares, recurriendo a la escala QUADAS-2 al ser la indicada para la evaluación de la calidad de los estudios. Dicha escala consiste en 4 dominios que evalúan la selección de pacientes, la prueba índice (DSC), el método de referencia (pruebas genéticas o moleculares de determinación de IDH) y la planificación temporal y fluidez. Cada dominio cuenta con una serie de preguntas cuyos resultados constatan el nivel de calidez de los estudios incluidos.
3. Resultados
El diagrama de flujo que representa la búsqueda bibliográfica se muestra en la Figura 1. En la búsqueda inicial se obtuvieron 66 en PubMed, 81 en Scopus y 69 en Web of Science y se añadió un artículo por búsqueda inversa. Finalmente, se seleccionaron 11 artículos de tipo observacional para realizar la revisión, recogiendo 10 artículos retrospectivos (17–26) y 1 artículo prospectivo (27).
Figura 1. Diagrama de flujo de la revisión sistemática.
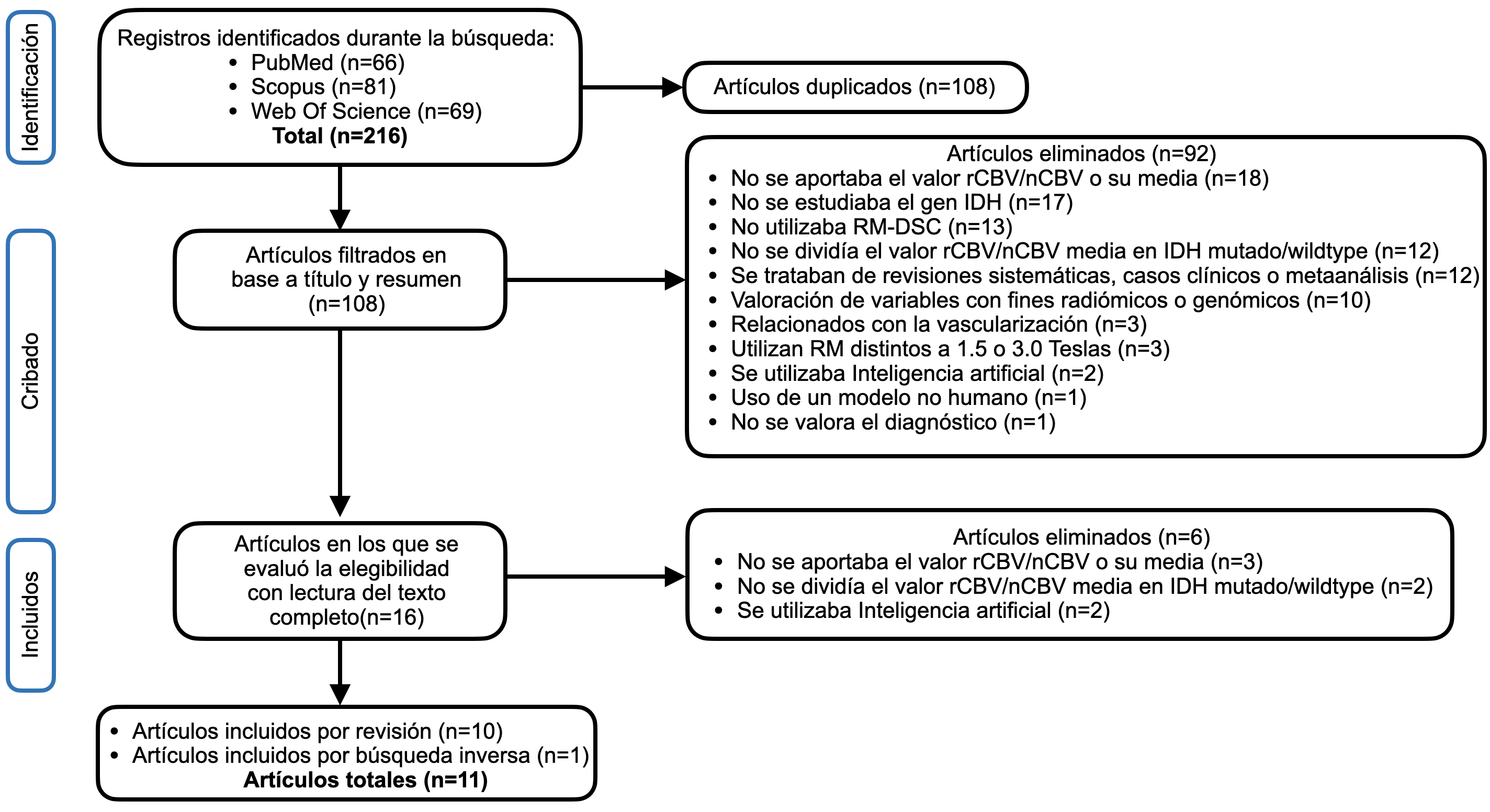
nCBV= volumen sanguíneo cerebral normalizado, rCBV= volumen sanguíneo cerebral relativo. RM-DSC= RM con contraste de susceptibilidad dinámica.
Las características de los artículos escogidos se recogen en la Tabla 2 y la Tabla 3. Además, los resultados de la escalas QUADAS-2, se pueden observar por dominios en las Tablas 4-7. Como observaciones reseñables, Song et al., Gezer et al., Ahn et al. y Brendle et al. no especificaron si los radiólogos que evaluaron la prueba índice (DSC) conocían de antemano el estado del gen IDH lo que puede introducir sesgos (24,26,27). En todos los estudios se encontraron numerosas diferencias en las variables relacionadas con los parámetros de adquisición y posprocesamiento de las imágenes de RM.
Tabla 2. Características de los artículos (I)
| Autor, año | Tipo de estudio | Muestra | Intervención | Comparación | Resultado de interés | Valor p | Resultado principal |
| Tan et al.; 2016 | Estudio observacional retrospectivo |
n=91; IDH-mutado n= 32, IDH-wildtype n= 59 |
Aplicación de parámetros de difusión como el rCBV y rCBV ratio en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con astrocitomas basado en el valor rCBV |
Grado II: – IDH-mutado rCBV media= 1,76 ± 0,72 – IDH-wildtype rCBV media= 4,14 ± 2,59 Grado III: – IDH-mutado rCBV media= 2,87 ± 2,40 – IDH-wildtype rCBV media= 5,16 ± 2,63 Grado IV: – IDH-mutado rCBV media= 3,34 ± 1,55 – IDH-wildtype rCBV media= 9,21 ± 4,72 |
Grado II p=0,005 Grado III p=0,045 Grado IV p=0,044 |
1, 2, 3 |
| Hempel et al.; 2018 | Estudio observacional retrospectivo |
n=100; IDH-mutado n=31, IDH wild type n=46, Codeleción 1p/19q n=23 |
Aplicación de parámetros de difusión como el rCBV en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con glioblastomas y astrocitomas basado en el valor rCBV |
IDH-mutado astrocitomas y glioblastomas rCBV media= 1,25 ± 0,49 IDH-wildtype astrocitomas y glioblastomas rCBV media= 2,60 ± 1,33 IDH-mutado oligodendroglioma rCBV media= 2,00 ± 0,57 |
p < 0,001 | 1, 2, 3, 4 |
| Ozturk et al.; 2021 | Estudio observacional retrospectivo |
n=47; IDH-mutado n=7, MGMT n=22, P53 mutado n=22 |
Aplicación de parámetros de difusión como el rCBV media y rCBV máx en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con glioblastomas basado en el valor rCBV. |
IDH-mutado rCBV media= 4,36 +/- 1,29 IDH-wildtype rCBV media= 7,12 +/- 2,42 |
p< 0,001 | 1, 2 |
| Lee et al.; 2019 | Estudio observacional retrospectivo |
n=110; IDH-mutado n=19, IDH-wildtype n=45, IDH-mutado y codeleción 1p19q n=46 |
Aplicación de parámetros de difusión como el nCBV en RM-DSC por el signo de desajuste de T2/FLAIR. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor nCBV. |
IDH-mutado nCBV media= 1,42 ± 0,44 IDH-wildtype nCBV media= 1,85 ± 0,75 |
p= 0,07 | 1, 2, 5 |
| Guo et al.; 2022 | Estudio observacional retrospectivo |
n=102; IDH-mutado n=54, IDH-wildtype n=48 |
Aplicación de parámetros de difusión como el rCBV y ADC en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor rCBV. |
IDH-mutado rCBV media= 3,64 ± 2,18 IDH-wildtype rCBV media= 7,46 ± 1,99 |
p< 0,01 | 1, 2, 4 |
| Sledzinska-Bebyn et al.; 2025 | Estudio observacional retrospectivo de cohortes |
n=67; IDH-mutado n=28, IDH-wildtype n=39 |
Aplicación de parámetros de difusión como el rCBV y rCBF en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor rCBV. |
IDH-mutado rCBV media= 5,2 IDH-wildtype rCBV media= 3,1 |
p< 0,05 | 1, 2, 4 |
| Song et al.; 2020 | Estudio observacional retrospectivo |
n=52; IDH-mutado n=9, IDH-wildtype n=30, IDH-mutado con codeleción 1p19q n=13 |
Aplicación de parámetros de difusión como el nCBV en RM-DSC y 18F-FET PET. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor nCBV. |
IDH-mutado nCBV media= 0,83 IDH-wildtype nCBV media= 2,78 IDH mutaco con codeleción 1p/19q nCBV media= 1,08 |
p < 0,010 | 1, 3, 6 |
| Gezeret et al.; 2020 | Estudio observacional prospectivo |
n=50; IDH-mutado n=22, IDH-wildtype n=28 |
Aplicación de parámetros de difusión como el rCBV y AUC en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con glioblastomas basado en el valor rCBV. |
IDH-mutado nCBV media= 1,92 ± 0,75 IDH-wildtype nCBV media= 3,07 ± 0,99 |
p < 0,001 | 1, 2, 3 |
| Ahn et al.; 2022 | Estudio observacional retrospectivo |
n=132 IDH-mutado n=87 |
Aplicación de parámetros de difusión como el nCBV en RM-DSC y RM-DCE. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor nCBV. |
IDH-mutado nCBV media= 1,27 ± 0,54 IDH-wildtype nCBV media= 1,61 ± 0,69 |
p = 0,001 | 1, 2 |
| Brendle et al.; 2020 | Estudio observacional retrospectivo | n=56 | Aplicación de parámetros de difusión como el rCBV en RM-DSC. | Determinación del estado mutacional de IDH en pacientes con astrocitomas basado en el valor rCBV. |
IDH-mutado rCBV media= 1,2 ± 0,6* IDH-wildtype rCBV media= 2,7 ± 1,4 * |
p < 0,001 | 1, 2 |
| Cindil et al.; 2021 | Estudio observacional retrospectivo |
n= 35; IDH-mutado n=10 IDH-wildtype n=25 |
Aplicación de parámetros de difusión como el nCBV en RM-DSC y DWI. | Determinación del estado mutacional de IDH en pacientes con gliomas basado en el valor rCBV. |
IDH-mutado rCBV media= 2,49 (2,22-3,01) IDH-wildtype rCBV media= 4,18 (3,26-5,71) |
p =0,002 | 1, 2, 3 |
RM-DSC= RM con contraste de susceptibilidad dinámica, nCBV= volumen sanguíneo cerebral normalizado, rCBV= volumen sanguíneo cerebral relativo, ADC= coeficiente de difusión aparente, AUC= área bajo la curva, rCBF= fluido sanguíneo cerebral relativo y T2/FLAIR= signo de desajuste de imágenes ponderadas en T2 y secuencias por técnica de inversión con supresión de fluido.
*En tumores astrocíticos
1 La RM-DSC puede ser un predictor no invasivo para la determinación del gen IDH.
2 Los valores rCBV/nCBV fueron menores en el grupo IDH-mutado que en el IDH-wildtype.
3 rCBV/nCBV permiten el estadiaje de los gliomas.
4 Se evidencia una relación entre la vascularización y la mutación IDH.
5 La combinación del signo de desajuste T2/FLAIR y el rCBV/nCBV es de gran utilidad clínica.
6 El 18F-FET PET y la RM-DSC suponen alternativas muy interesantes en el diagnóstico no invasivo de la mutación del gen IDH.
Tabla 3. Características de los artículos (II)
| Autor, año | Campo magnético utilizado | Parámetros de adquisición |
Software de procesamiento de las imágenes |
| Tan et al.; 2016 |
3.0 T RM; Siemens® |
TR: 1500 ms, TE: 30 ms, FA: 90° |
Syngo® MR B14 version “Perfusion” |
| Hempel et al.; 2018 |
3.0 T RM; Biograph mMR, Siemens® Healthcare, Erlangen, Germany |
TR: 1130 ms, TE: 31 ms, FA: NE |
MIPAV 7.4.0 and in-house Matlab®-based software (Matlab 2014b, MathWorks Natick, MA, USA) |
| Lu et al; 2021 |
3.0 T RM; Skyra, Siemens®, Germany |
TR:1500 ms, TE: 30 ms, FA: NE |
Functool MADC and BrainStat GVF |
| Ozturk et al.; 2021 |
3.0 T RM; Trio or Skyra, Siemens® Healthineers, Erlangen, Germany |
TR: 1500 ms, TE: 43 ms, FA: NE |
GenomOncology software |
| Lee et al., 2019 |
3.0 T RM; Achieva, Philips Medical Systems |
TR: 1808, TE: 40, FA: 35° |
NordicICE (NordicNeuroLab) |
| Guo et al, 2022 |
3.0 T RM; Achieva, Philips Healthcare |
TR: 3000, TE: 80, FA: 75° |
MedCalc |
| Sledzinska-Bebyn et al. 2025 | 1.5 T RM |
TR: NE, TE: NE, FA: NE |
NE |
| Song et al, 2020 |
3.0 T RM; GE Healthcare® |
TR: 1800 ms, TE: 15,5 ms, FA: 90º |
AW 4.7 postprocessing workstation |
| Gezar et al, 2020 |
1.5 T RM; Siemens-Aera® |
TR: NE, TE: NE, FA: NE |
Siemens Syngo® E11 |
| Ahn et al, 2022 |
3.0 T RM Achieva or Ingenia, Philips Medical Systems, Best, the Netherlands |
TR: 9000 ms, TE: 94 ms, FA: 60° |
NordicICE; NordicNeuroLab, Inc., Milwaukee, WI, USA |
| Brendle et al, 2020 |
3.0 T RM; Biograph mMR MR-PET, Siemens® Healthcare Erlangen Germany |
TR: 1130 ms, TE: 31 ms, FA: 60º |
Syngo MR Perfusion (Siemens® Healthineers, Erlangen, Germany) |
| Cindil et al, 2021 |
3.0 T RM; Siemens® AG, Erlangen, Germany |
TR:1500, TE: 30 ms, FA: 90° |
Software de desarrollo propio |
NE: No Especificado. TR= tiempo de repetición, TE= tiempo de eco y FA=ángulo de inclinación.
Tabla 4. Escala QUADAS-2, ámbito 1: selección de pacientes.
| Estudios | 1) ¿Se incluyó una muestra consecutiva o aleatoria de pacientes? | 2) ¿Se evitó un diseño de casos y controles? | 3) ¿Evitó el estudio exclusiones inadecuadas? |
Riesgo de sesgo: ¿Podría la selección de pacientes haber introducido sesgos? (basado en 1-4) |
Cuestiones relativas a la aplicabilidad: ¿Existe la preocupación de que los pacientes incluidos no coincidan con la pregunta de la revisión? (basado en 1-4) |
|---|---|---|---|---|---|
| Tan et al.; 2016 | Sí | Sí | Incierto | Incierto | Bajo |
| Hempel et al.; 2018 | Sí | Sí | Sí | Bajo | Bajo |
| Ozturk et al.; 2021 | Incierto | Sí | No, en el artículo excluyeron pacientes con esteroides. | Alto | Bajo |
| Lee et al.; 2019 | Sí | Sí | Sí | Bajo | Bajo |
| Guo et al.; 2022 | Sí | Sí | No (excluyeron 3 pacientes con DSC sin iVASO) | Bajo | Bajo |
| Sledzinska-Bebyn et al.; 2025 | Incierto | Sí | Sí | Bajo | Bajo |
| Song et al.; 2020 | Sí | Sí | No (se excluyeron codeleciones 1p19q incompletas y mutaciones IDH incompletas) | Alto | Bajo |
| Gezer et al.; 2020 | Sí | Sí | Incierto (no mencionado) | Incierto | Bajo |
| Ahn et al.; 2022 | Sí | Sí | No (se excluyeron niños y pacientes con cirugías previas, conclusiones no aplicables a pacientes con estas condiciones) | Alto | Bajo |
| Brendle et al.; 2020 | Sí | Sí | Sí | Bajo | Bajo |
| Cindil et al.; 2021 | Sí | Sí | Sí | Bajo | Bajo |
iVASO=Ocupación del espacio vascular basada en el flujo de entrada.
Tabla 5. Escala QUADAS-2, ámbito 2: prueba índice.
| Estudios | 1) Describa la prueba del índice y cómo se realizó e interpretó | 2) ¿Se interpretaron los resultados de la prueba índice sin conocer los resultados del método de referencia? |
Riesgo de sesgo: ¿Podría la realización o interpretación de la prueba del índice haber introducido sesgos? (basado en 1-2) |
Cuestiones relativas a la aplicabilidad: ¿Existe la sospecha de que la prueba del índice, su realización o su interpretación difieran de la pregunta de la revisión? |
| Tan et al.; 2016 | RM-DSC | Sí | Bajo | Bajo |
| Hempel et al.; 2018 | RM-DSC | Sí | Bajo | Bajo |
| Ozturk et al.; 2021 | RM-DSC | Sí | Bajo | Bajo |
| Lee et al.; 2019 | RM-DSC | Sí | Bajo | Bajo |
| Guo et al.; 2022 | RM-DSC | Sí | Bajo | Bajo |
| Sledzinska-Bebyn et al.; 2025 | RM-DSC | Sí | Bajo | Bajo |
| Song et al.; 2020 | RM-DSC | Incierto | Incierto | Bajo |
| Gezer et al.; 2020 | RM-DSC | Incierto | Incierto | Bajo |
| Ahn et al.; 2022 | RM-DSC | Incierto | Incierto | Bajo |
| Brendle et al.; 2020 | RM-DSC | Incierto | Incierto | Bajo |
| Cindil et al.; 2021 | RM-DSC | Sí | Bajo | Bajo |
RM-DSC= RM con contraste de susceptibilidad dinámica
Tabla 6. Escala QUADAS-2, ámbito 3: criterio de referencia.
| Estudios | 1) Describa la norma de referencia y cómo se realizó e interpretó | 2) ¿Es probable que la prueba de referencia clasifique correctamente la enfermedad objetivo? | 3) ¿Se interpretaron los resultados del método estándar de referencia sin conocer los resultados de la prueba índice? |
Riesgo de sesgo: ¿Podría la prueba de referencia, su realización o su interpretación haber introducido sesgos? (basado en 2- 3) |
Cuestiones relativas a la aplicabilidad: ¿Existe la posibilidad de que la condición objetivo definida por la prueba de referencia no se corresponda con la pregunta de la revisión? |
| Tan et al.; 2016 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Hempel et al.; 2018 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Ozturk et al.; 2021 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Lee et al.; 2019 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Guo et al.; 2022 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Sledzinska-Bebyn et al.; 2025 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Song et al.; 2020 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Gezer et al.; 2020 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Ahn et al.; 2022 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Brendle et al.; 2020 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
| Cindil et al.; 2021 | Estado IDH según pruebas genéticas/ moleculares | Sí | Incierto | Bajo | Bajo |
Tabla 7. Escala QUADAS-2, ámbito 4: planificación temporal y fluidez.
| Estudios | 1) ¿Hubo un intervalo adecuado entre la(s) prueba(s) índice y la prueba de referencia? | 2) ¿Recibieron todos los pacientes un patrón de referencia? | 3) ¿Recibieron todos los pacientes la misma prueba de referencia? | 4) ¿Se incluyó a todos los pacientes en el análisis? |
Riesgo de sesgo: ¿Podría el movimiento de pacientes haber introducido un sesgo? |
| Tan et al.; 2016 | Incierto | Sí | Sí | Sí | Bajo |
| Hempel et al.; 2018 | Sí (0-14 días) | Sí | Sí | Sí | Bajo |
| Ozturk et al.; 2021 | Incierto | Sí | Sí | Sí | Bajo |
| Lee et al.; 2019 | Incierto | Sí | Sí | Sí | Bajo |
| Guo et al.; 2022 | Incierto | Sí | Sí | Sí | Bajo |
| Sledzinska-Bebyn et al.; 2025 | Incierto | Sí | Sí | Sí | Bajo |
| Song et al.; 2020 | Incierto | Sí | Sí | Sí | Bajo |
| Gezer et al.; 2020 | Incierto | Sí | Sí | Sí | Bajo |
| Ahn et al.; 2022 | Incierto | Sí | Sí | Sí | Bajo |
| Brendle et al.; 2020 | Incierto | Sí | Sí | Sí | Bajo |
| Cindil et al.; 2021 | Sí (0-12 días) | Sí | Sí | Sí | Bajo |
Tan et al. (18) evaluaron la aplicación del rCBV y rCBV ratio, obtenidos mediante RM-DSC para determinar la relación entre la perfusión cerebral y el estado mutacional de IDH en gliomas. Los valores de rCBV media fueron consistentemente más bajos en los mutados en comparación con los wildtype, observándose una asociación en todos los grados tumorales (grado II p=0,005, grado III p=0,045 y grado IV p=0,044).
Hempel et al. (19) analizaron la variable rCBV media obtenida mediante RM-DSC, para evaluar su capacidad de determinar el estado mutacional de IDH en pacientes con gliomas. Los resultados mostraron diferencias significativas (p <0,001). Además, el percentil 90 de rCBV demostró un alto potencial para predecir el estatus mutacional de IDH.
Ozturk et al. (20) analizaron rCBV media y rCBV máx, obtenidos mediante RM-DSC, para evaluar las diferencias entre gliomas con IDH-mutado e IDH-wildtype. Aquellos con IDH-mutado presentaron un valor de rCBV media de 4,36 ± 1,29, mientras que los pacientes con IDH-wildtype mostraron un valor de rCBV media de 7,12 ± 2,42 (p <0,001). Entre las limitaciones de este artículo destaca que se excluyeron a pacientes en tratamiento con esteroides. Los esteroides se utilizan en pacientes con gliomas de alto grado con alto riesgo de edema cerebral, por lo que las conclusiones de este artículo no son extrapolables a dichos pacientes.
Lee et al. (21) analizaron la variable nCBV media, obtenida por RM-DSC, para evaluar la capacidad de diferenciar gliomas según el estado mutacional de IDH y la codeleción 1p/19q utilizando el signo de desajuste de imágenes ponderadas en T2 y secuencias por técnica de inversión con supresión de fluido (FLAIR, por sus siglas en inglés) de RM (T2/FLAIR). Los gliomas IDH-mutado presentaron un valor de nCBV media de 1,42 ± 0,44, mientras que los gliomas IDH-wildtype presentaron un valor de nCBV media de 1,85 ± 0,75 (p = 0,07). Aunque los resultados no arrojaron una asociación (p=0,07), se observó una tendencia hacia la distinción de los gliomas según el estado mutacional de IDH y la codeleción 1p/19q.
Guo et al. (22) analizaron rCBV media y coeficiente de difusión aparente (ADC, por sus siglas en inglés), obtenidos mediante RM-DSC, para determinar el estado mutacional de IDH en pacientes con gliomas. Los gliomas IDH-mutado presentaron un valor de rCBV media de 3,64 ± 2,18, mientras que los gliomas IDH-wildtype presentaron un valor de rCBV media de 7,46 ± 1,99 (p <0,01). Entre las limitaciones de este artículo destaca que se excluyeron a 3 pacientes con DSC sin Ocupación del espacio vascular basada en el flujo de entrada (iVASO, por sus siglas en inglés).
Sledzinska-Bebyn et al. (23) analizaron la variable rCBV media y flujo sanguíneo cerebral relativo (rCBF, por sus siglas en inglés) obtenidos mediante RM-DSC, para evaluar el estado mutacional de IDH en pacientes con gliomas. Los resultados mostraron que los gliomas IDH-wildtype presentaron un valor de rCBV media más alto que los gliomas IDH-mutado (p <0,05).
Song et al. (24) evaluaron diferencias en los valores de la Tomografía por emisión de positrones con O- (2-[18F]fluoroetil)-L-tirosina (18F-FET PET, por sus siglas en inglés) y CBV media medido con imagen ponderada por perfusión (PWI, por sus siglas en inglés) para analizar su relación con el grado tumoral y el estado de mutación. El valor de nCBV media presentó una diferencia significativa entre los gliomas IDH-mutado e IDH-wildtype. Además, fue el único parámetro capaz de diferenciar tumores con IDH-wildtype de tumores con IDH-mutado y codeleción 1p19q (p <0,010).
Gezer et al. (27) utilizaron técnicas avanzadas de RM, incluyendo espectroscopia por RM, perfusión por PWI y difusión por imagen ponderada por perfusión (DWI, por sus siglas en inglés), para analizar las diferencias en los valores de rCBV de PWI y ADC de DWI en gliomas de distinto grado y con diferentes estados de mutación de IDH. La diferencia en la rCBV media entre los gliomas IDH-mutado y wildtype fue significativa (p <0,001).
Brendle et al. (25) evaluaron valores de RM-DSC en pacientes no tratados, comparando entre astrocitomas IDH-wildtype e IDH-mutado. La diferencia de rCBV media entre los grupos a estudiar fue significativa (p <0,001), que sugieren que la rCBV podría ser un biomarcador útil para determinar IDH.
Ahn et al. (26) evaluaron las diferencias de nCBV media entre gliomas IDH-mutado e IDH-wildtype con RM-DSCI y RM-DCE. Los valores de nCBV fueron significativamente más bajos en los gliomas IDH-mutado que en los IDH-wildtype (p = 0,001). Entre las limitaciones de este artículo destaca que se excluyeron a pacientes infantiles y adultos con cirugías cerebrales previas.
Cindil et al. (17) evaluaron el estado de IDH en glioblastomas mediante la diferenciación de los parámetros diagnósticos obtenidos por DWI y PWI-DSC. Los valores de rCBV fueron significativamente más bajos en los gliomas IDH-mutado que en los wildtype (p = 0,002).
4. Discusión
En los resultados de esta revisión sistemática se observó que la determinación del parámetro de perfusión rCBV/nCBV obtenidos por RM-DSC puede ofrecer una valiosa información como procedimiento diagnóstico no invasivo para la determinación del estado mutacional del gen IDH en pacientes con gliomas cerebrales.
Todos los artículos hicieron constatar la existencia de diferencias en el valor del parámetro CBV medio en función del estado del gen IDH, como se ha recogido en la Figura 2.
Figura 2. Asociación entre los valores de rCBV/nCBV y el estado mutacional del gen IDH. Neuroimagen original desarrollada por los autores del artículo y figura creada en https://BioRender.com. Se plantea la duda de si la media del volumen sanguíneo cerebral relativo (rCBV) o el volumen sanguíneo cerebral normalizado (nCBV) son capaces de predecir el estado mutacional del gen IDH. La escala de colores de la imagen representa los distintos valores de rCBV/nCBV y su correspondencia con los colores empleados en la imagen.
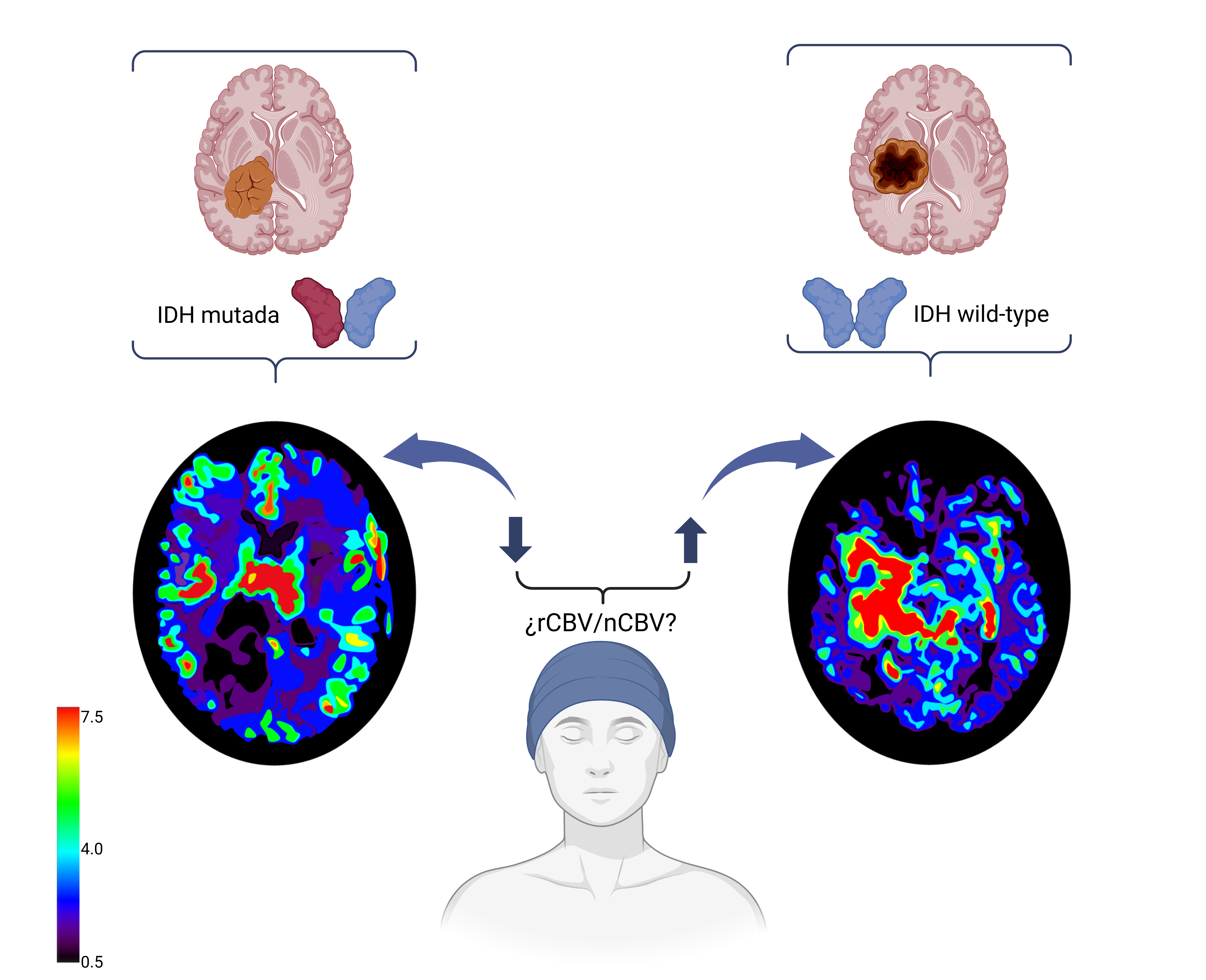
Los artículos plantearon la posible asociación entre un menor valor de CBV y la presencia de mutación del gen IDH en el tumor, en comparación con un mayor valor de CBV en los gliomas IDH-wildtype. En contraposición, otros estudios utilizaron otras variables, como CBV mediana y no observaron una asociación con la mutación del gen IDH (28). Por ello, se plantea que la media del CBV permite discernir el estado del gen IDH con una mayor validez. Sin embargo, la mayoría de los artículos valoraron la diferencia de medias sin proponer un punto de corte para la variable CBV que permita diferenciar el estado mutacional de IDH. Por contra, Gezer et al. establecieron el punto de corte en 2,15, con una sensibilidad del 85% y una especificidad del 64% (27). Por tanto, determinar un límite supondría un gran beneficio y permitiría valorar la instauración definitiva de la RM-DSC como técnica diagnóstica no invasiva en la tipificación del tumor.
Tan et al. recogieron la variable CBV en función del estadio tumoral y el estado del gen IDH de los pacientes (18). Los autores plantearon el posible uso del CBV como herramienta que permita la estratificación de los gliomas al observar diferencias significativas entre los distintos estadios tumorales. Gezer et al., Song et al., Hempel et al. y Cindil et al, encontraron una asociación entre la variable CBV y el gen IDH, así como con el estadio tumoral (17,20,24,27). Esto, apoya las hipótesis propuestas por Tan et al. y supone que se plantee la posibilidad de utilizar la variable CBV como un valor que permita diferenciar el estadio tumoral. Hempel et al., Guo et al. y Sledzinska-Bebyn et al. afirmaron la relación entre el valor del CBV y la vascularización en el tejido tumoral; esto respalda la menor angiogénesis en los gliomas IDH-mutado en comparación con los IDH-wildtype (21,22,24). Estos hallazgos refuerzan el potencial de la RM-DSC no sólo en la identificación del estado mutacional de IDH, sino también en su posible utilidad dentro de la clasificación molecular de los gliomas según la Organización Mundial de la Salud (OMS) siendo su última versión la expuesta en el año 2021(2,3). Por tanto, se plantea como objetivo distinto al que se persigue con la elaboración de esta revisión sistemática, indagar en la relación existente entre el valor del CBV medio y el grado de los gliomas cerebrales en futuras investigaciones. Adicionalmente, Lee et al. sugiere el beneficio de la utilización del signo de desajuste T2/FLAIR junto con la RM-DSC para determinar el estado mutacional del gen IDH, aún cuando en sus resultados no se observa una asociación (p= 0,07). Se sugiere que la utilización conjunta de CBV junto al signo de desajuste T2/FLAIR permitirían discernir el estado del gen IDH con una mayor precisión (23). Dadas las conclusiones de los autores, se plantea la necesidad de abordar estas hipótesis en futuras líneas de investigación. Todo esto, a fin de que aborden y esclarezcan la utilidad de la RM-DSC en otros ámbitos del diagnóstico y caracterización de los gliomas.
Entre las fortalezas de este estudio, destacamos la especificidad de los criterios de inclusión y exclusión, que permiten sugerir que la medición de la variable CBV media es un buen método de determinación del estado de IDH en gliomas, respecto a otras variables como la mediana, y percentiles varios; y la utilización de varias bases de datos en la búsqueda. La principal limitación de este estudio fue que la mayoría de los artículos hallados contaban con un tamaño muestral bajo, entre 35 y 110 pacientes. El tamaño de las muestras compromete la validez externa de los estudios al no poder garantizar que los pacientes estudiados representan adecuadamente a la población de pacientes con glioma. Del mismo modo, compromete la validez interna de las conclusiones, al disminuir la precisión de las estimaciones. Por otro lado, este estudio ha utilizado los parámetros rCBV y nCBV indistintamente debido a la gran variabilidad de variables estudiadas en el ámbito de la RM de perfusión. Así mismo, la heterogeneidad en la edad y parámetros de adquisición, explicados anteriormente, puede haber contribuido a la introducción de confusión en las conclusiones de este estudio. A fin de resolver esto, la realización de un metaanálisis que estratifique por estas variables podría dar mayor validez a los resultados obtenidos, si bien no se ha realizado por limitación de tiempo. En última instancia, este estudio no ha considerado el posible sesgo de publicación ya que no se han incluido documentos de literatura gris, que son comunes en radiología y podrían haber contribuido a reducirlo.
5. Conclusiones
La utilización del parámetro de perfusión rCBV/nCBV medio en RM-DSC ha demostrado ser un marcador capaz de predecir el estado mutacional del gen IDH en tumores cerebrales. Sin embargo, es necesario la realización de nuevas líneas de investigación que definan el punto de corte del parámetro rCBV/nCBV medio con objeto de estandarizar su uso y permitir su aplicación en la práctica clínica habitual.
Declaraciones
Agradecimientos
Queremos agradecer al equipo editor de AMU y a los organizadores del “Curso de Publicación de Artículos Biomédicos”, por brindarnos la oportunidad y el apoyo necesario para poder publicar este artículo.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés.
Financiación
Ninguna
Referencias
1. Weller M, Wen PY, Chang SM, Dirven L, Lim M, Monje M, et al. Glioma. Nat Rev Dis Primer. 2024;10(1):33.
2. Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro-Oncol. 2021;23(8):1231-51.
3. Moñino CC. CLASIFICACIÓN ACTUAL SEGÚN LA OMS DE LOS GLIOMAS INFILTRANTES. [Internet]. [citado 2025 Mar 31]. Disponible en: https://www.geino.es/privado/guias/ClasificacionGliomasInfiltrantes.pdf
4. Reuss DE. Updates on the WHO diagnosis of IDH-mutant glioma. J Neurooncol. 2023;162(3):461-9.
5. Fujii T, Khawaja MR, DiNardo CD, Atkins JT, Janku F. Targeting isocitrate dehydrogenase (IDH) in cancer. Discov Med. 2016;21(117):373-80.
6. Lu Y, Kwintkiewicz J, Liu Y, Tech K, Frady LN, Su YT, et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 2017;77(7):1709-18.
7. Yang K, Wu Z, Zhang H, Zhang N, Wu W, Wang Z, et al. Glioma targeted therapy: insight into future of molecular approaches. Mol Cancer. 2022;21(1):39.
8. Du N, Zhou X, Mao R, Shu W, Xiao L, Ye Y, et al. Preoperative and Noninvasive Prediction of Gliomas Histopathological Grades and IDH Molecular Types Using Multiple MRI Characteristics. Front Oncol. 2022;12:873839.
9. Zhang S, Zhang J, Hu X, Yin S, Yuan Y, Xia L, et al. Noninvasive detection of brain gliomas using plasma cell-free DNA 5-hydroxymethylcytosine sequencing. Int J Cancer. 2023;152(8):1707-18.
10. Riche M, Marijon P, Amelot A, Bielle F, Mokhtari K, Chambrun MP de, et al. Severity, timeline, and management of complications after stereotactic brain biopsy. J Neurosurg. 2022;136(3):867-76.
11. Riche M, Amelot A, Peyre M, Capelle L, Carpentier A, Mathon B. Complications after frame-based stereotactic brain biopsy: a systematic review. Neurosurg Rev. 2021;44(1):301-7.
12. Aronen HJ, Perkiö J. Dynamic susceptibility contrast MRI of gliomas. Neuroimaging Clin N Am. 2002;12(4):501-23.
13. Shiroishi MS, Castellazzi G, Boxerman JL, D’Amore F, Essig M, Nguyen TB, et al. Principles of T2 *-weighted dynamic susceptibility contrast MRI technique in brain tumor imaging. J Magn Reson Imaging JMRI. 2015;41(2):296-313.
14. Kim M, Jung SY, Park JE, Jo Y, Park SY, Nam SJ, et al. Diffusion- and perfusion-weighted MRI radiomics model may predict isocitrate dehydrogenase (IDH) mutation and tumor aggressiveness in diffuse lower grade glioma. Eur Radiol. 2020;30(4):2142-51.
15. Álvarez-Torres MDM, Fuster-García E, Juan-Albarracín J, Reynés G, Aparici-Robles F, Ferrer-Lozano J, et al. Local detection of microvessels in IDH-wildtype glioblastoma using relative cerebral blood volume: an imaging marker useful for astrocytoma grade 4 classification. BMC Cancer. 2022;22(1):40.
16. Declaración PRISMA 2020: una guía actualizada para la publicación de revisiones sistemáticas. Rev Esp Cardiol. 2021;74(9):790-9.
17. Cindil E, Sendur HN, Cerit MN, Erdogan N, Celebi F, Dag N, et al. Prediction of IDH Mutation Status in High-grade Gliomas Using DWI and High T1-weight DSC-MRI. Acad Radiol. 2022;29:S52-62.
18. Tan W, Xiong J, Huang W, Wu J, Zhan S, Geng D. Noninvasively detecting Isocitrate dehydrogenase 1 gene status in astrocytoma by dynamic susceptibility contrast MRI. J Magn Reson Imaging JMRI. 2017;45(2):492-9.
19. Hempel JM, Schittenhelm J, Klose U, Bender B, Bier G, Skardelly M, et al. In Vivo Molecular Profiling of Human Glioma. Clin Neuroradiol. 2019;29(3):479-91.
20. Ozturk K, Soylu E, Cayci Z. Correlation between dynamic susceptibility contrast perfusion MRI and genomic alterations in glioblastoma. Neuroradiology. 2021;63(11):1801-10.
21. Lee MK, Park JE, Jo Y, Park SY, Kim SJ, Kim HS. Advanced imaging parameters improve the prediction of diffuse lower-grade gliomas subtype, IDH mutant with no 1p19q codeletion: added value to the T2/FLAIR mismatch sign. Eur Radiol. 2020;30(2):844-54.
22. Guo L, Li X, Cao H, Hua J, Mei Y, Pillai JJ, et al. Inflow-based vascular-space-occupancy (iVASO) might potentially predict IDH mutation status and tumor grade in diffuse cerebral gliomas. J Neuroradiol J Neuroradiol. 2022;49(3):267-74.
23. Śledzińska-Bebyn P, Furtak J, Bebyn M, Bartoszewska-Kubiak A, Serafin Z. Investigating glioma genetics through perfusion MRI: rCBV and rCBF as predictive biomarkers. Magn Reson Imaging. 2025;117:110318.
24. Song S, Wang L, Yang H, Shan Y, Cheng Y, Xu L, et al. Static 18F-FET PET and DSC-PWI based on hybrid PET/MR for the prediction of gliomas defined by IDH and 1p/19q status. Eur Radiol. 2021;31(6):4087-96.
25. Brendle C, Klose U, Hempel JM, Schittenhelm J, Skardelly M, Tabatabai G, et al. Association of dynamic susceptibility magnetic resonance imaging at initial tumor diagnosis with the prognosis of different molecular glioma subtypes. Neurol Sci Off J Ital Neurol Soc Ital Soc Clin Neurophysiol. 2020;41(12):3625-32.
26. Ahn SH, Ahn SS, Park YW, Park CJ, Lee SK. Association of dynamic susceptibility contrast- and dynamic contrast-enhanced magnetic resonance imaging parameters with molecular marker status in lower-grade gliomas: A retrospective study. Neuroradiol J. 2023;36(1):49-58.
27. Gezer B, Mutlukan A, Sahinoglu M, Karabagli P, Koktekir E, Karabagli H. Comparison of immunogenetic properties of glial tumors with advanced magnetic resonance imaging findings. Turk Neurosurg. 2020;30(3):422-427.
28. Kickingereder P, Sahm F, Radbruch A, Wick W, Heiland S, Deimling A von, et al. IDH mutation status is associated with a distinct hypoxia/angiogenesis transcriptome signature which is non-invasively predictable with rCBV imaging in human glioma. Sci Rep. 2015;5:16238.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 6/02/2025
Fecha de revisión: 21/02/2025
Fecha de aceptación: 15/04/2025
Cita el artículo: González-Blanco I, Jiménez-González S, Montoro-Martín J. Utilidad de los parámetros de perfusión por resonancia magnética para la predicción del estado del gen IDH en gliomas cerebrales: una revisión sistemática. AMU. 2025;7(1):80-91.
URI: https://hdl.handle.net/10481/105377
