Patricia López-Gómez 1; Manuel González-Alcaide 2
1 Grupo de Investigación en Biomateriales, Biomecánica e Ingeniería de Tejidos (BBT), Universitat Politècnica de Catalunya (UPC)
2 Facultad de Medicina, Universidad de Granada (UGR)
Translated by:
Celia Amat-Galdeano 3; Paula Gómez-Martín 3; Alicia Martínez-Martínez 3; Marta María Pérez-Puerta 3; Aïcha Rabbaj 3; Inés San Juan-Sánchez 3
3 Faculty of Translation and Interpreting, University of Granada (UGR)
La columna vertebral constituye una pieza clave en la estructura del organismo. Debido a su localización, composición y su gran longitud, está expuesta a numerosos factores que pueden reducir la calidad de vida del paciente. La ingeniería tisular es un área de investigación biomédica emergente que combina los principios de la ingeniería, la biología y la medicina para crear sustitutos morfofuncionales de tejidos y órganos. Esta disciplina ha experimentado un desarrollo tecnológico exponencial en las últimas dos décadas gracias al desarrollo de la impresión y la bioimpresión tridimensional (3D). Ante este auge sin precedente, se presenta una revisión bibliográfica de los avances en la fabricación de biomodelos y guías para la planificación quirúrgica, así como en la fabricación de sustitutos de cartílago intervertebral mediante ingeniería tisular, con especial énfasis en las técnicas de bioimpresión 3D, una herramienta muy prometedora en el tratamiento de un gran número de patologías de columna.
Palabras clave: impresión 3D, bioimpresión, cartílago intervertebral, columna, ingeniería tisular.
Keywords: 3D printing, bioprinting, intervertebral cartilage, spine, tissue engineering
Introducción
La columna vertebral constituye una pieza clave en la estructura del organismo. Debido a su gran longitud, localización y composición, está expuesta a numerosos factores de estrés como la tracción mecánica, los traumatismos y otras patologías que pueden empeorar la calidad de vida del paciente (1).
La enfermedad degenerativa de la columna es un motivo importante de discapacidad en el mundo, hasta 266 millones de personas padecen esta enfermedad cada año (2). En ella se incluyen diversas patologías como la espondilolistesis, la degeneración del disco intervertebral o la estenosis espinal lumbar (3), concurriendo en una amplia variedad de dolencias, entre las que se incluyen el dolor en extremidades inferiores, debilidad y lumbalgias graves. Las patologías de columna resultan en una clara reducción en la calidad de vida del paciente (2, 4).
A este respecto, la complejidad estructural y funcional de la columna, asociada a la avascularidad y escasa capacidad de regeneración del tejido cartilaginoso del disco intervertebral, ha suscitado la necesidad de buscar nuevas terapias en la ingeniería tisular, diferentes de los métodos tradicionales, tales como técnicas farmacológicas (analgésicos, esteroides, antinflamatorios no esteroideos…) o intervenciones (colocación de varillas para intentar corregir las desviaciones, técnicas de descompresión y fusión…) (5, 6), que actualmente resultan ineficientes (7).
La ingeniería tisular es un área emergente en la investigación biomédica, la cual combina los principios básicos de la ingeniería, biología y medicina para la fabricación de sustitutos funcionales de uso terapéutico (8). Esta disciplina ha tenido un desarrollo tecnológico exponencial en los últimos años como muestra el desarrollo de la impresión y bioimpresión tridimensional (3D) de tejidos y órganos (9–11). Actualmente muchos de estos materiales y productos de terapias avanzadas ya han sido transferidos con éxito a la práctica clínica (12). Mediante el uso y combinación de células, biomateriales y factores bioactivos, y a través del uso de una técnica de biofabricación óptima, es posible elaborar tejidos artificiales que asemejan la estructura y función de los tejidos nativos, incluido el tejido cartilaginoso (13).
El objetivo de este trabajo es realizar una revisión bibliográfica acerca del estado actual de las técnicas de impresión 3D, discutir sus posibles aplicaciones en la ingeniería de tejidos y particularmente en la reparación de estructuras de la columna severamente dañadas por estrés o por defectos secundarios a una patología. Se presentan las bases biológicas de los tejidos en estudio y los tratamientos actuales en uso. Los avances relacionados con modelos y guías para la planificación quirúrgica y la fabricación de sustitutos de cartílago intervertebral mediante ingeniería tisular y bioimpresión también serán presentados. Por último, se discutirá sobre las futuras estrategias de investigación y su posible traslación clínica.
Bases biológicas del tejido óseo y cartilaginoso de la columna
El origen embrionario de la totalidad de la arquitectura vertebral es mesodérmico y endodérmico: la mayor parte de la columna vertebral junto con las vértebras, las placas terminales de tejido condral y el anillo fibroso procede del mesodermo, mientras que el núcleo pulposo, procede del endodermo. El desarrollo de la columna vertebral comienza durante el proceso de gastrulación donde el mesodermo que rodea la notocorda se divide en tres áreas: paraxial, lateral e intermedia. El mesodermo paraxial se diferencia en 42 pares de somitos; cada uno se divide en un dermomiotomo y un esclerotomo. El esclerotomo se convertirá en el esqueleto de la columna vertebral (14).
La histología de la vértebra y el disco intervertebral revela tejidos altamente especializados y organizados, con una buena integración entre ellos. Sin embargo, puede sufrir deterioros mecánicos y cambios morfofisiológicos que contribuyen a la patología con el envejecimiento y las lesiones (3, 15).
El disco intervertebral es una estructura condral con grandes similitudes a otros tejidos cartilaginosos en relación con su bioquímica, pero morfológicamente muy dispares (3). Es el primer tejido conectivo que muestra signos de deterioro y envejecimiento (16). Por ello, para tratar una lesión de la forma más segura y eficaz posible, es crucial conocer en detalle su estructura, composición y organización celular.
Terapias avanzadas en el tratamiento de las lesiones de columna
La pérdida de la estructura, el deterioro de la matriz de cartílago y/o la falta de integridad de la propia vértebra ocurren durante una lesión de columna (3, 13). Problemas de locomoción derivados de la pérdida de alineación de la médula espinal, flexibilidad o en la anatomía neural contribuyen a la aparición de enfermedades que afectan a la calidad de vida del paciente (16), tales como hernias (protrusiones o extrusiones), estenosis, osteofitos, espondilolistesis y espondilosis. Dichas patologías han obtenido gran relevancia en la investigación biomédica, dando pie a numerosas técnicas paliativas y reparativas en el tratamiento de las lesiones de columna, entre las que destacan la terapia celular y la ingeniería tisular (3, 17).
Terapia celular
La terapia celular hace referencia a los tratamientos que contienen células como principal componente activo para el tratamiento de enfermedades o patologías (18). Estas técnicas han demostrado un gran potencial en el tratamiento de lesiones de columna, consolidándose como alternativa a técnicas clásicas o a los reemplazos por prótesis, lo que se traduce en una mejora de la calidad de vida del paciente (13).
Ingeniería tisular
Ante las limitaciones inherentes de las técnicas clásicas, se han propuesto diversas estrategias combinatorias entre células, biomateriales y moléculas señalizadoras (8), entre las que encontramos el uso de hidrogeles con carga celular (12), implantes basados en andamios que promueven el reclutamiento de células con moléculas señalizadoras (sin aporte celular externo), y técnicas basadas en la generación de sustitutos libres de biomateriales (17), pudiendo incluirse además métodos complementarios de terapia génica para conseguir expresar factores de crecimiento específicos (13).
Una de las tecnologías propuestas para mejorar y optimizar los tratamientos de este tipo de lesiones es la impresión 3D aplicada al campo de la ingeniería tisular, ya que podría suponer una alternativa a los métodos tradicionales, que actualmente resultan ineficientes (19).
Generalidades sobre la impresión 3D
La impresión 3D es una técnica de prototipado y fabricación aditiva utilizada en la construcción de modelos de arquitectura compleja, es decir, un mecanismo de alta precisión que se lleva a cabo mediante un proceso de adición sucesiva de capas del material en cuestión. Esta técnica facilita la fabricación y replicación de estructuras complejas con gran precisión y de forma controlada, incluyendo factores como: la forma externa, la geometría interna, su porosidad e interconectividad. Al mismo tiempo, este proceso permite una alta reproducibilidad y repetibilidad de los resultados (20).
La idea fue introducida por primera vez, en la década de los 70 por Pierre A. L. Ciraud, quien describió un método de fabricación en el que, mediante material pulverizado y la acción de un haz de alta energía, se lograba la solidificación de las capas (21).
Una década más tarde, la estereolitografía (Stereo Litography Apparatus, o SLA) se convirtió en la primera técnica de fabricación aditiva aplicada en medicina para el modelo de cirugía de implantes aloplásticos (22, 23). En la década de los 90 se realizó uno de los primeros trabajos en ingeniería tisular usando la SLA por Widmer y su grupo para la regeneración de nervios periféricos (24); esa misma década, Emanuel Sachs y su grupo patentaron “técnicas de impresión tridimensional” con aplicación médica (25).
En los últimos 10 años se han optimizado las diferentes técnicas de impresión, desarrollándose impresoras con varios cabezales para imprimir distintos materiales simultáneamente; además, se ha implementado el uso de técnicas de imagen médica y software de diseño asistido por ordenador (21, 26, 27).
Métodos de impresión 3D
Las tecnologías de fabricación aditiva pueden ser clasificadas en cuatro grupos principales:
- Técnica de impresión basada en la polimerización en cubeta/batea
Un polímero fundido que ha sido previamente colocado en una batea (Vat polymerization, o VAT) es polimerizado por una fuente de luz (figura 1.1). En esta categoría podemos encontrar las técnicas de SLA, el procesamiento de luz directa (Digital Light Processing, o DLP) y el procesamiento de luz directa continua (Continuous Digital Light Processing, o CDLP).
- Técnica de impresión a base de polvo
Un láser recorre la zona donde se ha depositado el material, fusionando las partículas de polvo en capas sucesivas (figura 1.2). Aquí se encuentran la sinterización selectiva por láser (Selective laser sintering, o SLS), la sinterización directa de metal por láser (Direct Metal Laser Sintering, o DMLS), la fusión selectiva por láser (Selective Laser Melting, o SLM) y la fusión por haz de electrones (Electron Beam Melting, o EBM).
- Técnica de impresión a base de gotas (inyección de tinta)
Se emplea un chorro preciso de material líquido sobre un sustrato para construir el modelo mediante la adición de capas (figura 1.3). Existen varias técnicas como el modelado de inyección múltiple (Multi Jet Modeling, o MJM), el modelado por deposición de cera (Wax Deposition Modeling, o WDM), la transferencia inducida por láser (laser-induced forward transfer, o LIFT) y la inyección de aglutinante (Binder Jetting, o BJ).
- Técnica de impresión basada en la extrusión
Se deposita un polímero fundido a través del extrusor de la impresora, que deposita el material capa por capa sobre el sustrato (figura 1.4). Aquí se incluyen el modelado de deposición fundida (Fused Deposition Modeling, o FDM) y la escritura con tinta directa (Direct Ink Write, o DIW) (21, 22, 28, 29).
Figura 1. Representación gráfica de los diferentes tipos de impresión 3D. 1. Impresión basada en la polimerización en cubeta. 2. Impresión a base de polvo. 3 Impresión a base de gotas. 4. Impresión basada en la extrusión.

Fundamentos técnicos de la impresión 3D para la reparación de patologías en columna
Generación de modelos anatómicos a partir de imágenes DICOM para la planificación quirúrgica
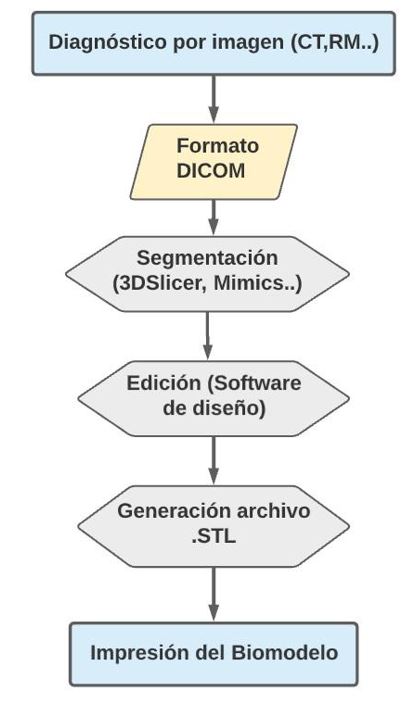
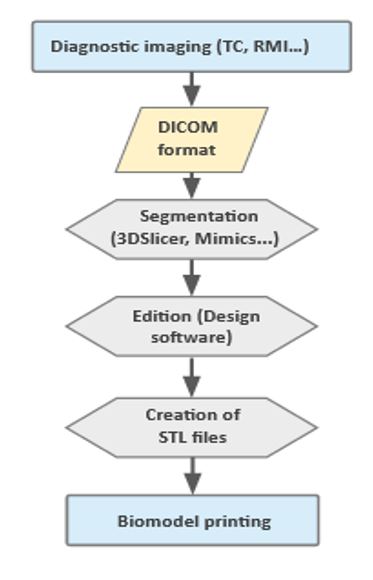
El primer paso para obtener información acerca del estado actual de la patología y poder elaborar un protocolo de actuación es realizar un diagnóstico por imagen que se lleva a cabo mediante tomografía computarizada (TC) o imagen por resonancia magnética (RM). Posteriormente almacenamos la información de las imágenes obtenidas en formato DICOM (Data Imaging and Communications in Medicine), con las cuales seremos capaces de obtener un diseño computerizado gracias a un software de diseño asistido por ordenador (Computer-Aided Design, o CAD) y un programa de segmentación específico. Por último, generamos un archivo de capas en formato STL (STereoLithography) que podemos transferir a nuestra impresora (7) (figura 2). Los biomodelos que se imprimen a partir de esta técnica proporcionan información muy exacta sobre el estado concreto de la patología del paciente, suponiendo un extraordinario apoyo a la hora de planear cirugías, minimizando el tiempo y los posibles riesgos asociados (30).
Figura 2. Diagrama de flujo que representa los pasos a seguir para la generación de un modelo anatómico mediante impresión 3D a partir de imagen médica.
Impresión de biomateriales para ingeniería tisular
Los biomateriales son esenciales en la ingeniería de tejidos. Proporcionan el soporte estructural para que las células se adhieran, migren, proliferen, produzcan su propia matriz extracelular y se diferencien en un fenotipo determinado (22). Debe ser biocompatible, bioactivo, poroso y tener una resistencia mecánica adecuada. De esta forma se da una correcta difusión de las células, nutrientes y desechos del tejido. La biodegradabilidad del biomaterial es clave, ya que permite el reemplazo progresivo del tejido artificial por tejido neoformado (31, 32).
Tradicionalmente se han empleado métodos de fabricación convencionales como electrospinning (33) lixiviación, liofilización o moldeado (27). Sin embargo, estas técnicas carecen de la precisión necesaria para controlar la porosidad, geometría interna o disposición espacial de los componentes (22).
La fabricación aditiva ha ganado bastante terreno como técnica de fabricación alternativa de estos soportes estructurales permitiendo el control del tamaño, forma y arquitectura del andamio y una alta precisión para sintonizar la porosidad y degradabilidad, así como la distribución tridimensional de los elementos (27, 33). Otras ventajas son su diseño individual y personalizado y su alta reproducibilidad y rendimiento. Los métodos más utilizados son FDM (21), SLS/DMLS, BJ y VAT (22).
Uso de las tecnologías de impresión 3D en patologías de columna.
Se ha reportado el uso de la impresión 3D para diversas patologías de columna. Entre ellas cabe destacar la fabricación de implantes individualizados con alto índice de osteointegración y precisión anatómica para:
- Una fusión intersomática lumbar lateral en una paciente con radiculopatía intratable a causa de una compresión de disco (34).
- La extracción de un tumor óseo primario destructivo a nivel de T9 en una paciente con cifoescoliosis progresiva (35).
- Y el tratamiento de quistes sintomáticos en el canal del sacro mediante el uso de duramadre artificial impresa en 3D junto con radiculoplastia (36).
Bioimpresión 3D
El enfoque ideal de fabricación aditiva para andamiajes requiere la incorporación de células, bien sea sembrándolas en el biomaterial una vez impreso éste, o incorporándolas como material imprimible. Cualquier técnica que incluya células en la formulación de la tinta, a diferencia de las técnicas de impresión 3D previamente descritas, se denomina “bioimpresión” (22).
La bioimpresión es capaz de generar estructuras tridimensionales compuestas mediante un biomaterial, que actúa como soporte, y componentes celulares (29, 37). Es posible agregar otros elementos como fármacos, componentes de la matriz extracelular, factores de crecimiento y otros factores biológicos (38) con el objetivo de construir tejidos semejantes al tejido nativo o biomiméticos (29). Las 3 tecnologías mayormente utilizadas son la inyección de biotinta, la extrusión y la bioimpresión asistida por luz (38).
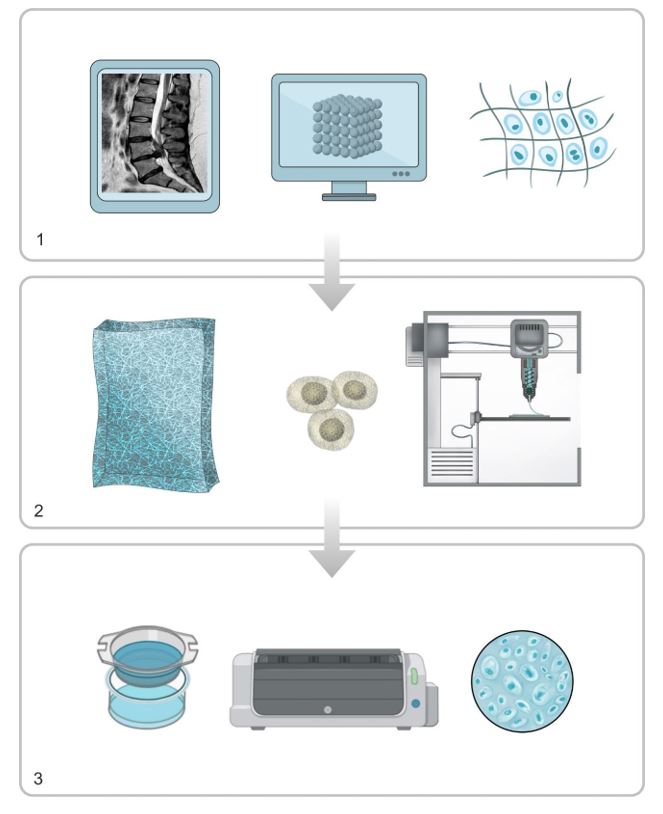
El proceso de bioimpresión 3D está dividido en 3 fases:
Pre-procesamiento. Diseño del objeto 3D con un software de diseño CAD y se caracterizan los datos para optimizar la geometría. El preprocesamiento implica el diseño digital obtenido a partir de imágenes médicas (TC o RM) y la selección de componentes (figura 3.1).
Procesamiento. Generación de capas y proceso de impresión del modelo mediante la técnica elegida. Las imágenes diseñadas se envían al sistema y se preparan los biomateriales y biotintas (figura 3.2).
Post-Procesamiento. Adaptación del tejido impreso para su posterior uso. Este proceso puede llevar días o incluso semanas. Durante esta fase las construcciones impresas se transfieren a un biorreactor para la maduración del tejido (figura 3.3) (21, 27 ,29, 39).
Figura 3. Representación gráfica del proceso general de bioimpresión .1, pre-procesamiento. 2, procesamiento. 3, post-procesamiento.
Generación de sustitutos cartilaginosos por técnicas de bioimpresión 3D
Los desafíos asociados a la arquitectura y a la complejidad del tejido condral exigen una elección ideal de los componentes y técnicas de biofabricación (28); las interacciones entre las células y el andamiaje determinan la calidad final del modelo impreso, por lo que la elección de cada elemento es crucial (29).
Biomateriales
Los biomateriales utilizados en la bioimpresión de cartílago pueden ser de origen natural, sintético, o bien una mezcla de ambos, que permite la obtención de mejores propiedades biomecánicas y biológicas (28, 29, 40).
Los polímeros naturales empleados en mayor medida son: colágeno, componente más abundante en la matriz extracelular de mamíferos; agarosa, un hidrogel polimérico termosensible; alginato, derivado de la pared de las algas pardas; quitosano, polisacárido que puede formar una matriz de gel; ácido hialurónico, polisacárido aniónico que promueve la regeneración de tejidos condrales; y gelatina (28, 29, 41). Su principal ventaja es su biocompatibilidad y baja citotoxicidad. Sin embargo, poseen una baja capacidad de manipulación y resolución de impresión debido a su viscosidad (41).
Para solventar estas limitaciones, se emplean polímeros sintéticos en el desarrollo de hidrogeles, ya que, a diferencia de los polímeros naturales, sus propiedades pueden ser controladas. Esta característica les confieren ventajas respecto a la resistencia mecánica, estabilidad, manipulación e incluso biodegradabilidad (40). Algunos comúnmente usados son: poli-alcohol-vinílico, polietilenglicol, ácido poli-láctico-co-glicólico y policaprolactona (29).
Teniendo en cuenta las propiedades de cada tipo, un hidrogel mixto, con un componente natural y otro sintético solventa estas limitaciones, obteniéndose propiedades biomecánicas y biológicas mejoradas, que supera los resultados obtenidos por separado (40). Por ello habitualmente se emplean andamiajes compuestos:
- La combinación de alginato con nanocelulosa (19, 29) ha demostrado propiedades muy favorables relacionadas con la estabilización del constructo y disminución de la viscosidad (41).
- Los compuestos de quitosano y poloxámeros favorecen el crecimiento de condrocitos, y su combinación con acrilato produce un hidrogel nanoestructurado.
- Los bioandamios generados a partir de quitosano (80%), policaprolactona (15%) e hidroxiapatita (5%) permiten emular características similares al cartílago humano y son capaces de ser sometidas a un procesamiento histológico (42).
- La adición de grupos laterales a hidrogeles de gelatina o ácido hialurónico facilitan la reticulación o “crosslinking” entre polímeros, resultando en una matriz muy estable (43).
- Los hidrogeles de polietilenglicol pueden conjugarse con péptidos o proteínas de adhesión, lo que les confiere capacidades de interacción fisiológica entre célula y material, etc. (28, 29).
Fuentes celulares
Pese a que el uso de condrocitos diferenciados en la bioimpresión ha sido ampliamente descrito (19, 29, 44, 45), es difícil obtenerlos de manera directa debido a su baja tasa de renovación, la limitación de fuentes de extracción y la complejidad intrínseca de su recolección. Esto ha llevado a que se prueben fuentes celulares alternativas, como las células madre (41). Estas constituyen un grupo de células indiferenciadas con capacidad ilimitada para la división y alto potencial de regeneración.
Dependiendo de su potencial de diferenciación, las células madre se clasifican como totipotentes, pluripotentes, multipotentes o unipotentes, y según sea su origen, como embrionarias, fetales, o “adultas” (somáticas) (8, 17), empleando fundamentalmente estas últimas. El empleo de células madre mesenquimales (Mesenchymal Stem Cells, o MSCs) implica eficacia y seguridad para el paciente (19, 46), suponiendo un riesgo menor en la formación de teratomas o diferenciación no deseada, en comparación con la acción de las células madre embrionarias (41). Pueden ser obtenidas de numerosos tejidos, siendo las derivadas de la médula ósea y del tejido adiposo (8) las más empleadas en tratamientos para el tejido condral (28, 46), ya que muestran un excelente potencial condrogénico (47). Las células del tejido adiposo resultan muy prometedoras para el tratamiento en trastornos musculoesqueléticos. El tejido adiposo es una gran fuente de células madre por varios motivos: son muy abundantes en el organismo, pueden obtenerse fácilmente del paciente mediante procedimientos mínimamente invasivos y tienen un gran rendimiento a nivel celular (48). Además, diversos estudios han demostrado que el tratamiento con co-cultivos reporta mejores resultados que aquellos con monocultivos, siendo una mezcla de MSCs y condrocitos en proporción 4:1 la más eficiente (41).
Limitaciones de las tecnologías de impresión 3D
Estas limitaciones hacen referencia a la falta de resolución de la imagen 3D y a la presencia de artefactos durante la generación del modelo 3D. En algunos casos estos artefactos afectaron a la arquitectura de prótesis fabricadas, volviéndolas totalmente inutilizables. También deben ser considerados el elevado poder económico para adquirir todo el equipo, la velocidad de impresión y la falta de profesionales cualificados que sepan manejar las impresoras durante emergencias (49).
Perspectivas de futuro de las tecnologías de impresión 3D para la reparación de patologías de columna
La tecnología de impresión 3D fue descrita hace décadas, pero la bioimpresión es mucho más reciente. Aunque evoluciona muy rápido, y muestra una capacidad y flexibilidad para generar tejidos vivos con mínimos o nulos efectos secundarios, los estudios in vivo se encuentran todavía en una etapa inicial: existe una brecha entre las propiedades biológicas y mecánicas que hay que solventar (29), ya que es imprescindible estabilizar el implante e integrarlo con el tejido nativo circundante (45). Sin embargo, los avances y resultados obtenidos permiten ser optimistas respecto a la bioimpresión 3D de sistemas complejos y la resolución de la escasez de donantes de tejidos y órganos (29, 50).
Traslación clínica
La tecnología de impresión 3D ya forma parte de una serie de rutinas clínicas, tales como la generación de modelos a partir de imágenes de referencia tomadas mediante TC o RM, o la fabricación de prototipos con fines educativos para ayudar a los cirujanos en la planificación de cirugías complejas (50).
Para la traslación clínica de la bioimpresión se han de cumplir las normas y requisitos de seguridad: esterilidad, contenido de endotoxinas, reproducibilidad y, debido a la presencia de células, someterse a la ley correspondiente por la cual deben incorporarse buenas prácticas de fabricación, procurando una manipulación mínima y un procesamiento en sistema cerrado. Sin embargo, no existe una normativa vigente actualizada que evalúe la calidad, seguridad y eficiencia de la bioimpresión 3D en pacientes. Hasta el momento solo se han procurado recomendaciones para la realización de estudios preclínicos y clínicos por parte de la Sociedad Internacional de Reparación del Cartílago (29, 50).
Conclusiones
Las tecnologías de impresión 3D podrían ofrecer grandes ventajas para el paciente: el desarrollo de un tratamiento totalmente personalizado y capaz de solventar con precisión lesiones de gran complejidad, permitiendo de la misma manera afrontar futuras intervenciones quirúrgicas con mayor seguridad y conocimiento previo. En relación con la bioimpresión 3D, existen obstáculos que deben superarse antes de su puesta en valor en dimensiones clínicamente relevantes. Es necesario evaluar la totalidad de combinaciones posibles entre los biomateriales, fuentes celulares y moléculas, a fin de establecer una construcción ideal que haga factible un sustituto cartilaginoso óptimo, tanto en estructura como en función. Para ello es fundamental seleccionar cuidadosamente los materiales con compatibilidad celular y propiedades mecánicas adecuadas.
También es necesaria una regulación a todos los niveles: desde el plano legislativo, que contemple las técnicas de biofabricación con células hasta el uso de materiales para guías e implantes generados mediante impresión 3D, con el fin de asegurar una fabricación y una aplicación correcta y segura para el paciente.
A pesar de estas limitaciones, es esclarecedor que el futuro de la gestión de las lesiones de columna se encuentre en el desarrollo de técnicas interdisciplinares, que aúnen las capacidades de la medicina regenerativa y la bioingeniería. La próxima generación de implantes biológicamente compatibles, capaces de tratar daños en la columna, será una realidad gracias a la implementación de la impresión 3D en hospitales, como una alternativa a las técnicas vigentes.
Declaraciones
Agradecimientos
Los autores de este trabajo agradecen la implicación de los coordinadores y docentes de los cursos «Producción y traducción de artículos biomédicos (III ed.)» y «Traducción inversa de artículos científicos biomédicos (español-inglés)», así como al equipo de traducción al inglés de este artículo.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de interés.
Referencias
- Artificial discs for lumbar and cervical degenerative disc disease -update: an evidence-based analysis. Ont Health Technol Assess Ser. 2006;6(10):1–98.
- Ravindra VM, Senglaub SS, Rattani A, Dewan MC, Härtl R, Bisson E, et al. Degenerative Lumbar Spine Disease: Estimating Global Incidence and Worldwide Volume. Glob spine J. 2018;8(8):784–94.
- Bowles RD, Setton LA. Biomaterials for intervertebral disc regeneration and repair. Biomaterials. 2017;129:54–67.
- Hoy D, March L, Brooks P, Blyth F, Woolf A, Bain C, et al. The global burden of low back pain: estimates from the Global Burden of Disease 2010 study. Ann Rheum Dis. 2014;73(6):968–74.
- Kalichman L, Hunter DJ. Diagnosis and conservative management of degenerative lumbar spondylolisthesis. Eur spine J Off Publ Eur Spine Soc Eur Spinal Deform Soc Eur Sect Cerv Spine Res Soc. 2008;17(3):327–35.
- Cunin V. Early-onset scoliosis: current treatment. Orthop Traumatol Surg Res. 2015;101(1 Suppl):S109-18.
- Cho W, Job AV, Chen J, Baek JH. A Review of Current Clinical Applications of Three-Dimensional Printing in Spine Surgery. Asian Spine J. 2018;12(1):171–7.
- Hunziker EB, Lippuner K, Keel MJB, Shintani N. An educational review of cartilage repair: precepts & practice–myths & misconceptions–progress & prospects. Osteoarthr Cartil. 2015;23(3):334–50.
- Lippincott Williams & Wilkins. Histology for pathologists. MILLS S, editor. 2019.
- Sheha ED, Gandhi SD, Colman MW. 3D printing in spine surgery. Ann Transl Med. 2019;7(Suppl 5):S164.
- Burnard JL, Parr WCH, Choy WJ, Walsh WR, Mobbs RJ. 3D-printed spine surgery implants: a systematic review of the efficacy and clinical safety profile of patient-specific and off-the-shelf devices. Eur Spine J [Internet]. 2020;29(6):1248–60. Disponible en: https://doi.org/10.1007/s00586-019-06236-2
- Bonhome-Espinosa AB, Campos F, Durand-Herrera D, Sánchez-López JD, Schaub S, Durán JDG, et al. In vitro characterization of a novel magnetic fibrin-agarose hydrogel for cartilage tissue engineering. J Mech Behav Biomed Mater. 2020;104:103619.
- Álvarez E, Ripoll PL, Restrepo A, Forriol F. Revisión de la reparación del cartílago. Posibilidades y resultados. Trauma (Spain). 2010.
- Kalamchi L, Valle C. Embryology, Vertebral Column Development. In Treasure Island (FL); 2021.
- Roberts S, Evans H, Trivedi J, Menage J. Histology and pathology of the human intervertebral disc. J Bone Joint Surg Am. 2006;88 Suppl 2:10–4.
- Urban JPG, Roberts S. Degeneration of the intervertebral disc. Arthritis Res Ther. 2003;5(3):120–30.
- Caldwell KL, Wang J. Cell-based articular cartilage repair: the link between development and regeneration. Osteoarthr Cartil. 2015;23(3):351–62.
- Kolios G, Moodley Y. Introduction to stem cells and regenerative medicine. Respiration. 2013;85(1):3–10.
- Daly AC, Freeman FE, Gonzalez-Fernandez T, Critchley SE, Nulty J, Kelly DJ. 3D Bioprinting for Cartilage and Osteochondral Tissue Engineering. Adv Healthc Mater. 2017;6(22).
- Cui H, Nowicki M, Fisher JP, Zhang LG. 3D Bioprinting for Organ Regeneration. Adv Healthc Mater. 2017;6(1).
- Jamróz W, Szafraniec J, Kurek M, Jachowicz R. 3D Printing in Pharmaceutical and Medical Applications – Recent Achievements and Challenges. Pharm Res. 2018;35(9):176.
- Liaw CY, Guvendiren M. Current and emerging applications of 3D printing in medicine. Biofabrication. 2017.
- Anderl H, Zur Nedden D, Mühlbauer W, Twerdy K, Zanon E, Wicke K, et al. CT-guided stereolithography as a new tool in craniofacial surgery. Br J Plast Surg. 1994;47(1):60–4.
- Widmer MS, Gupta PK, Lu L, Meszlenyi RK, Evans GR, Brandt K, et al. Manufacture of porous biodegradable polymer conduits by an extrusion process for guided tissue regeneration. Biomaterials. 1998;19(21):1945–55.
- Haggerty J, Cima M, Williams P, inventores; Sachs E, titular. (1993). Técnicas de Impresión Tridimensional. Patente Estadounidense. 5,204,055 04/28/1993.
- Richter DL, Schenck RCJ, Wascher DC, Treme G. Knee Articular Cartilage Repair and Restoration Techniques: A Review of the Literature. Sports Health. 2016;8(2):153–60.
- Sabino MA, Loaiza M, Dernowsek J, Rezende R, Da Silva JVL. Técnicas para la fabricación de andamios poliméricos con aplicaciones en ingenierÍa de tejidos. Rev Latinoam Metal y Mater. 2017.
- Vijayavenkataraman S, Yan W-C, Lu WF, Wang C-H, Fuh JYH. 3D bioprinting of tissues and organs for regenerative medicine. Adv Drug Deliv Rev. 2018;132:296–332.
- Huang Y, Zhang XF, Gao G, Yonezawa T, Cui X. 3D bioprinting and the current applications in tissue engineering. Biotechnology Journal. 2017.
- D’Urso PS, Williamson OD, Thompson RG. Biomodeling as an aid to spinal instrumentation. Spine (Phila Pa 1976). 2005;30(24):2841–5.
- Moroni L, Boland T, Burdick JA, De Maria C, Derby B, Forgacs G, et al. Biofabrication: A Guide to Technology and Terminology. Trends Biotechnol. 2018;36(4):384–402.
- Elkasabgy NA, Mahmoud AA. Fabrication Strategies of Scaffolds for Delivering Active Ingredients for Tissue Engineering. AAPS PharmSciTech. 2019;20(7):256.
- Sun J, Vijayavenkataraman S, Liu H. An Overview of Scaffold Design and Fabrication Technology for Engineered Knee Meniscus. Mater (Basel, Switzerland). 2017;10(1).
- Siu TL, Rogers JM, Lin K, Thompson R, Owbridge M. Custom-Made Titanium 3-Dimensional Printed Interbody Cages for Treatment of Osteoporotic Fracture-Related Spinal Deformity. World Neurosurg. 2018;111:1–5.
- Choy WJ, Mobbs RJ, Wilcox B, Phan S, Phan K, Sutterlin CE 3rd. Reconstruction of Thoracic Spine Using a Personalized 3D-Printed Vertebral Body in Adolescent with T9 Primary Bone Tumor. World Neurosurg. 2017;105:1032.e13-1032.e17.
- Liu B, Wang Z, Lin G, Zhang J. Radiculoplasty with reconstruction using 3D-printed artificial dura mater for the treatment of symptomatic sacral canal cysts: Two case reports. Medicine (Baltimore). 2018;97(49):e13289.
- Fricain JC, De Olivera H, Devillard R, Kalisky J, Remy M, Kériquel V, et al. Impression 3D en médecine régénératrice et ingénierie tissulaire. Medecine/Sciences. 2017; 33 (1) 52-59.
- Zhu W, Ma X, Gou M, Mei D, Zhang K, Chen S. 3D printing of functional biomaterials for tissue engineering. Current Opinion in Biotechnology. 2016.
- O’Brien CM, Holmes B, Faucett S, Zhang LG. Three-Dimensional Printing of Nanomaterial Scaffolds for Complex Tissue Regeneration. Tissue Eng Part B Rev [Internet]. 2015;21(1):103–14.
- Roseti L, Cavallo C, Desando G, Parisi V, Petretta M, Bartolotti I, et al. Three-Dimensional Bioprinting of Cartilage by the Use of Stem Cells: A Strategy to Improve Regeneration. Mater (Basel, Switzerland). 2018;11(9).
- Apelgren P, Amoroso M, Lindahl A, Brantsing C, Rotter N, Gatenholm P, et al. Chondrocytes and stem cells in 3D-bioprinted structures create human cartilage in vivo. PLoS One. 2017;12(12):e0189428.
- Láinez Ramos AJ, Rivera Izquierdo M. Synthesis and characterization of a cartilage model using hydroxyapatite, chitosan and polycaprolactone. Actual Medica. 2017;102(800):7–12.
- Duchi S, Onofrillo C, O’Connell CD, Blanchard R, Augustine C, Quigley AF, et al. Handheld Co-Axial Bioprinting: Application to in situ surgical cartilage repair. Sci Rep. 2017;7(1):5837.
- Shim JH, Lee JS, Kim JY, Cho DW. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. J Micromechanics Microengineering. 2012;
- Cui X, Breitenkamp K, Finn MG, Lotz M, D’Lima DD. Direct human cartilage repair using three-dimensional bioprinting technology. Tissue Eng Part A. 2012;18(11–12):1304–12.
- Lopa S, Mondadori C, Mainardi VL, Talò G, Costantini M, Candrian C, et al. Translational Application of Microfluidics and Bioprinting for Stem Cell-Based Cartilage Repair. Stem Cells Int. 2018;2018:6594841.
- Żylińska B, Silmanowicz P, Sobczyńska-Rak A, Jarosz Ł, Szponder T. Treatment of Articular Cartilage Defects: Focus on Tissue Engineering. In Vivo. 2018;32(6):1289–300.
- Rivera-Izquierdo M, Cabeza L, Láinez-Ramos-Bossini A, Quesada R, Perazzoli G, Alvarez P, et al. An updated review of adipose derived-mesenchymal stem cells and their applications in musculoskeletal disorders. Expert Opin Biol Ther. 2019;19(3):233–48.
- Martelli N, Serrano C, van den Brink H, Pineau J, Prognon P, Borget I, et al. Advantages and disadvantages of 3-dimensional printing in surgery: A systematic review. Surgery. 2016;159(6):1485–500.
- Mouser VHM, Levato R, Bonassar LJ, D’Lima DD, Grande DA, Klein TJ, et al. Three-Dimensional Bioprinting and Its Potential in the Field of Articular Cartilage Regeneration. Cartilage. 2017;8(4):327–40.
3D Printing Technologies Applied in Tissue Engineering for the Reparation of Degenerative Diseases of the Spine
The spine is a key part of the structure of our organism. Due to its length, location and composition, it is exposed to numerous factors that may reduce the quality of life of patients. Tissue engineering is an emerging area of biomedical research that combines the principles of engineering, biology and medicine in order to create morphofunctional substitutes for tissues and organs. This discipline has experienced exponential technological advances over the last two decades thanks to the development of three-dimensional (3D) printing and bioprinting. Given this unprecedented growth, the authors have decided to elaborate a bibliographic revision of the advances in the production of biomodels and guides for surgical planning, as well as in the production of intervertebral cartilage substitutes by tissue engineering. This revision will focus on 3D bioprinting techniques, which are a very promising tool in the treatment of a large number of spine diseases.
Keywords: 3D printing, bioprinting, intervertebral cartilage, spine, tissue engineering
Introduction
The spine is a key part of the structure of our organism. It is exposed to numerous stress factors, such as mechanical traction, trauma, and other diseases, due to its length, location, and composition, which may reduce the quality of life of the patient (1).
The degenerative disease of the spine is a major cause of global disability, with around 266 million people suffering from it each year (2). It includes diverse pathologies like spondylolisthesis, intervertebral disc degeneration or lumbar spinal stenosis (3), which cause a wide range of diseases such as lower limb pain, weakness, and serious low back pain. Spine pathologies significantly reduce the quality of life of patients (2, 4).
The structural and functional complexity of the spine, together with the vascularity and poor regenerative capacity of the cartilaginous tissue of the intervertebral disc have caused the necessity of seeking new therapies in tissue engineering, different from traditional methods which are currently ineffective. Among these traditional methods are, pharmacological techniques (analgesics, steroids, non-steroidal anti-inflammatories…) or procedures (placing steel rods to try to correct curvatures of the spine, decompression and fusion techniques…) (5, 6), which are currently ineffective (7).
Tissue engineering is an emerging area of biomedical research that combines the basic principles of engineering, biology, and medicine in order to create functional substitutes for therapeutic use (8). This discipline has experienced exponential technological advances in recent years as evidenced by the development of three-dimensional (3D) printing and bioprinting of tissues and organs (9-11). Nowadays, many of these materials and advanced therapy products have already been successfully put into clinical practice (12). It is possible to produce artificial tissues that resemble the structure and function of native tissues, including cartilaginous tissue (13), by using and combining cells, biomaterials, and bioactive factors, and through the use of an optimal biofabrication technique.
The aim of this paper is to elaborate a bibliographical revision of the current state of 3D printing techniques, discuss their possible applications in tissue engineering and, more particularly, in the repair of spine structures severely damaged by stress or by any secondary defect due to a disease. The biological basis of the tissues under study and current treatments (in use) will be presented below. Advances in models and guides for surgical planning and the production of intervertebral cartilage substitutes by tissue engineering and bioprinting will also be described. Lastly, future research strategies and their possible clinical translation will be discussed.
Biological basis of bone and cartilaginous tissues of the spine
The embryonic origin of the entire vertebral structure is mesodermal and endodermal: a major part of the spine is derived from the mesoderm, together with the vertebrae, the end plates of chondral tissue and the annulus. In contrast, the nucleus pulposus is originated in the endoderm.
The development of the spine starts during the gastrulation process, when the mesoderm surrounding the notochord is divided into three areas: paraxial, lateral, and intermediate. The paraxial mesoderm is differentiated into 42 pairs of somites, each divided into a dermomyotome and a sclerotome. The sclerotome becomes the skeleton of the spine (14).
Histology of the vertebra and the intervertebral disc reveals highly specialized and organized tissues that are well integrated with each other. However, it can suffer from mechanical deterioration and morphophysiological changes that contribute to diseases when aging and injuring (3,15).
The intervertebral disc presents a chondral structure, which resembles other cartilaginous tissues in terms of biochemistry, although it significantly differs from these tissues in morphological terms (3). It is the first connective tissue that manifests signs of deterioration and aging (16). Therefore, the safest and most effective way to treat an injury requires a deep understanding of the structure, composition, and cellular organization.
Advanced therapies for the treatment of spine injuries
Loss of structure, deterioration of the cartilage matrix and/or lack of integrity of the vertebra itself may occur during a spine injury (3,13). Locomotion problems derived from the loss of spinal cord alignment, flexibility or neural anatomy may lead to diseases that reduce the quality of life of the patient (16), such as herniation (disc protrusion or disc extrusion), stenosis, osteophytes, spondylolisthesis, and spondylosis. These diseases have become highly relevant in biomedical research, contributing to the development of many palliative and reparative techniques in the treatment of spine injuries, especially cellular therapy and tissue engineering (3,17).
Cellular therapy
Cellular therapy refers to the treatments that use cells as the main active component to treat diseases or pathologies (18). These techniques have a great potential in the treatment of spine injuries and have become an alternative to traditional techniques or prosthetic replacements, which translates into an improvement in the quality of life of patients (13).
Tissue engineering
Due to the limitations attached to traditional techniques, a variety of combinatorial strategies between cells, biomaterials and signalling molecules (8) have been suggested. Some of these strategies include the use of cell-loaded hydrogels (12), scaffold-based implants that promote cell recruitment with signalling molecules (without external cellular input), techniques based on the production of biomaterial-free substitutes (17). These strategies may also include additional gene therapy methods to express specific growth factors (13).
3D printing applied in tissue engineering is one of the technologies proposed to improve and optimize the treatments for this type of injury. It could be an alternative to traditional methods, which are currently inefficient (19).
Basic concepts of 3D printing
3D printing is a prototyping and additive production technique used in the construction of complex architectural models, that is, a high-precision mechanism that is accomplished through a process of successive addition of layers of the material concerned. This technique facilitates the production and replication of complex structures with high precision and in a controlled way, considering factors such as external shape, internal geometry, porosity, and interconnectivity. Simultaneously, this process enables high reproducibility and repeatability of the results obtained (20).
This idea was first introduced in the 1970s by Pierre A. L. Ciraud, who described a production method in which the solidification of layers (21) was achieved by sputtering material and a high-energy beam.
A decade later, StereoLithography Apparatus (SLA) became the first additive production technique applied in medicine for the surgical model of alloplastic implants (22, 23). One of the first works in tissue engineering using this technology for peripheral nerves regeneration (24) was conducted by Widmer and his group in the 1990s. In the same decade, Emanuel Sachs and his group also patented “three-dimensional printing techniques” for medical application (25).
In the last ten years, multiple printing techniques have been optimized. Multi-head printers have been developed in order to print different materials simultaneously. Furthermore, the use of medical imaging techniques and computer-aided design software has been introduced (21, 26, 27).
3D printing techniques:
Additive manufacturing technologies can be classified into four different techniques.
- Vat polymerization (VAT) based printing technique
A molten polymer previously located in a vat is polymerized by a light source (figure 1.1). This process may be performed with techniques such as SLA techniques, Digital Light Processing (DLP) and Continuous Digital Light Processing (CDLP) can be found.
- Powder-based 3D printing technique
A laser goes through the area where the material has been deposited, fusing the dust particles into successive layers (figure 1.2). This process may be performed with the techniques of Selective Laser Sintering (SLS), Direct Metal Laser Sintering (DMLS), Selective Laser Melting (SLM) and Electron Beam Melting (EBM).
- Droplet-based printing technique (inkjet)
A precise stream of liquid material is directed towards a substrate in order to build a model by layering (figure 1.3). This process may be performed with the techniques of Multi Jet Modeling (MJM), the Wax Deposition Modeling (WDM), the Laser-Induced Forward Transfer (LIFT) and the Binder Jetting (BJ).
- Extrusion-based 3D printing technique
A molten polymer is deposited through the extruder of the 3D printer, which layers the material over the substrate (figure 1.4). This method uses the techniques of Fused Deposition Modeling (FDM) and Direct Ink Write (DIW) (21, 22, 28, 29).
Figure 1. Graphical representation of the different techniques used in 3D printing.
- Vat polymerization-based printing. 2. Powder-based 3DP (3D printing). 3. Droplet-based printing. 4. Extrusion-based printing.

Technical fundamentals of 3D printing regarding the repair of spine diseases
Creation of anatomical models based on DICOM images for chirurgical planification
The first step in order to obtain information regarding the current state of the disease and create an action protocol is an imaging diagnostic. This may be performed with the techniques of Computed Tomography (CT) or Magnetic Resonance Imaging (MRI). The information of the images will be collected afterwards in DICOM (Digital Imaging and Communication on Medicine) format. This technique will be used to obtain a computerized design with a Computer-Aided Design (CAD) software and a particular segmentation programme. Lastly, a layering file will be generated in STL (STereoLithography) format in order to be sent to the 3D printer (7) (figure 2). The resulting printed biomodels provide very accurate information about the specific status of the patients’ disease, which can represent an extraordinary support in surgery planning, as it can help lessen the time and possible risks related to the procedure (30).
Figure 2. Flowchart of the required steps in order to create an anatomical model based on medical images with 3D printing techniques.
Printing of biomaterials in tissue engineering
Biomaterials are essential in tissue engineering. They provide structural support for cells to adhere, migrate, proliferate, produce their own extracellular matrix (ECM) and distinguish themselves in a specific phenotype (22). This phenotype must be biocompatible, bioactive, and porous, and have a proper mechanical strength. Moreover, the biodegradability of the biomaterial is key to the progressive replacement of artificial tissue for neoformed tissue (31,32).
Conventional techniques such as electrospinning (33), lixiviation, lyophilization or moulding (27) have been commonly used. Nevertheless, these techniques lack the precision required in order to control the porosity, internal geometry and spatial arrangement of the components (22).
Additive manufacturing has become more relevant as an alternative way of fabricating this structural support. This allows the control of the size, shape and architecture of the scaffold, as well as a high level of precision, which is necessary in order to tune the porosity and degradability, and the tridimensional distribution of the elements (27,33). Other advantages are its customized individual design, its high reproducibility and its efficiency. The most employed techniques are FDM (21), SLS/DMLS, BJ and VAT (22).
Usage of 3D printing technologies regarding spine diseases.
3D printing has been used in various spine diseases. The most remarkable uses are the fabrication of individualized implants with high rates of osseointegration and anatomical precision, the lateral lumbar interbody fusion in a patient with intractable radiculopathy due to disc compression (34), the removal of a T9 destructive bone tumor in a patient with progressive kyphoscoliosis (35), and the treatment of symptomatic cysts in the sacral canal by the use of artificial printed dura mater among with radiculopathy (36).
3D bioprinting
The ideal approach towards additive fabrication for scaffolds includes cell incorporation, which may be performed either by sowing them in the biomaterial once it has been printed or by incorporating them directly as printing material. Any technique including cells in ink formulation different to the previously mentioned 3D printing techniques is called bioprinting (22).
Bioprinting enables the creation of tridimensional compound structures with biomaterials, which act as a support, and cellular components (29, 37). It is also possible to add other elements as pharmacs, components of the ECM, and growth and other biological factors (38) in order to create tissues that resemble native tissue or biomimetics (29). The three most used technologies are bioink injection, extrusion and light-assisted bioprinting (38).
The process of 3D bioprinting is divided into 3 different phases.
Pre-processing. The 3D object is designed with a CAD software and data is characterized in order to optimize geometry. Pre-processing implies the digital design obtained with medical images (CT or RMI) and the selection of components (figure 3.1).
Processing. The generation of layers and printing process of the model is performed with the selected technique. Designed images are sent to the system. Biomaterials and bioinks are prepared (figure 3.2).
Post-processing. Adaptation of the printed tissue for its subsequent use. This process can take days or even weeks, since printed constructions are transferred to a bioreactor for tissue maturation (figure 3.3) (21, 27, 29, 39).
Figure 3. Graphical representation of the general bioprinting process.
- Pre-processing. 2. Processing. 3. Post-processing.

Creation of cartilaginous substitutes by 3D bioprinting techniques
The challenges associated with the architecture and complexity of chondral tissue require making faultless decisions on the components and techniques related to biofabrication (28). The interactions between the cells and the scaffold are determining for the quality of the final result of the printed model. Therefore, choosing the best option for every single element is crucial (29).
Biomaterials
The biomaterials used in cartilage bioprinting can be of natural or synthetic origin, or a mixture of both, resulting in improved biomechanical and biological properties (28, 29, 40).
The most common natural polymers used are: collagen, the most abundant component in the extracellular matrix of mammals; agarose, a thermosensitive polymeric hydrogel; alginate, derived from the wall of brown algae; chitosan, polysaccharide that can form a gel matrix; hyaluronic acid (HA), anionic polysaccharide that promotes chondral tissue regeneration; and gelatin (28, 29, 41). Their main benefit is their biocompatibility and low cytotoxicity. However, they possess a low manipulation capacity and printing resolution due to their viscosity (41).
To overcome these limitations, synthetic polymers are used in the development of hydrogels since, unlike natural polymers, their properties can be controlled. This gives them some advantages in terms of mechanical strength, stability, manipulation and even biodegradability (40). Some of the synthetic polymers most commonly used are: poly(vinyl alcohol) (PVA), poly(ethylene) glycol (PEG), poly(lactic-co-glycolic acid) (PLGA), and poly-caprolactone (PCL) (29).
Taking into account the properties of each type, a mixed hydrogel created with a natural and a synthetic component solves these limitations. As a result, improved biomechanical and biological properties are obtained, which exceeds the results achieved separately (40). For this reason, composite scaffolds are usually used.
The most common combinations are:
-The combination of alginate with nanocellulose (19, 29), as it has shown really favorable properties related to the construct stabilization and viscosity decrease (41).
-The combination of chitosan and poloxamers compounds favors the growth of chondrocytes, and the combination of those compounds with acrylate produces a nanostructured hydrogel.
-The combination of chitosan (80%), PCL (15%) and hydroxyapatite (5%) produce bioscaffolds that allow the emulation of characteristics resembling human cartilage and are capable of being subjected to a histological processing (42).
-The combination of side groups with either gelatin hydrogels or HA in order to facilitate crosslinking between polymers, which results in a very stable matrix (43).
-The combination of PEG hydrogels with either peptides or adhesive proteins in order to confer them physiological cell-material interaction abilities, etc. (28, 29).
Cellular sources
Although the use of differentiated chondrocytes in bioprinting has been widely described (19, 29, 44, 45), it is difficult to obtain them directly due to their low renewal rate, the limitation of extraction sources and the inherent complexity of their collection. As a result, new alternative cellular sources have been tested, such as stem cells (41). These cells form a group of undifferentiated cells with an unlimited capacity of division and a high regeneration potential.
Depending on their differentiation potential, stem cells are classified as totipotent, pluripotent, multipotent, or unipotent. According to their origin, they are classified as embryonic stem cells, fetal stem cells, or “adult” stem cells (somatic) (8, 17), the latter being the most commonly used. The use of Mesenchymal Stem Cells (MSCs) implies efficacy and safety for the patient (19, 46), posing a lower risk in the formation of teratomas or unwanted differentiation compared to the action of embryonic stem cells (41). They can be obtained from a large number of tissues. Those derived from bone marrow and adipose tissue (8) are the most widely used in chondral tissue treatments (28, 46), as they show an excellent chondrogenic potential (47). Adipose tissue cells are really promising for the treatment of musculoskeletal disorders, such as the adipose tissue is a huge source of stem cells for several reasons: they are very abundant in the human organism, they can be obtained easily from the patient through minimally invasive procedures, and they have great efficiency at cellular level (48). In addition, several studies have demonstrated that the treatment with co-cultures produces better results than those performed with monocultures, being the mixture of MSCs and chondrocytes in a 4:1 ratio the most efficient one (41).
Limitations of 3D printing technologies
These limitations refer to the lack of resolution of the 3D image and the presence of devices during the generation of the 3D model. In some cases, these devices affected the architecture of manufactured prostheses, making them totally unusable. It is also important to mention the high cost of all the equipment, the printing speed and the lack of qualified professionals who know how to operate the printers during emergencies (49).
Future prospects of 3D printing technologies for the treatment of spinal pathologies
3D printing technology was described decades ago, but bioprinting is much more recent. Although it evolves quite fast, showing ability and flexibility to generate living tissues with minimal or no side effects, in vivo studies are still at an early stage. There is a gap between the biological and mechanical properties that must be bridged (29), as it is essential to stabilize the implant and integrate it with the surrounding native tissue (45).
However, the advances and results obtained allow optimism about 3D bioprinting of complex systems and the solution of shortage of tissue and organ donors (29, 50).
Clinical translation
3D printing technology is already part of a number of clinical routines, such as the generation of models based on reference images taken via CT or MRI, and the fabrication of prototypes for educational purposes to assist surgeons in the planning of complex surgeries (50).
For the clinical translation of bioprinting, safety standards and requirements must be met: sterility, endotoxin content and reproducibility. Furthermore, due to the presence of cells, this translation must be subject to the corresponding law, incorporating good manufacturing practices, ensuring minimal manipulation and closed-system processing.
However, there are no current updated regulations that evaluate quality, safety and efficiency of 3D bioprinting in patients. Up to now, only recommendations for the preclinical and clinical studies have been provided by the International Cartilage Regeneration & Joint Preservation Society (29, 50).
Conclusions
3D printing technologies could offer great advantages for the patient, such as the development of a totally personalized treatment capable of accurately solving highly complex injuries. This would make possible facing future surgical operations with greater safety and prior knowledge.
As for 3D bioprinting, there are obstacles that need to be overcome before it can be used in clinically relevant environments. It is necessary to evaluate all the possible combinations between biomaterials, cell sources and molecules in order to establish a perfect construction that makes possible an optimal cartilage substitute, both in structure and function. For this purpose, it is essential to carefully select materials with adequate cell compatibility and mechanical properties.
Regulation is also needed at all levels, from the legislative level, considering cell-based biomanufacturing techniques, to the use of materials for guides and implants generated by 3D printing in order to ensure a correct and safe manufacture and application for the patient.
Despite these limitations, it is enlightening that the future of spine injuries management lies in the development of interdisciplinary techniques, which bring together the capabilities of regenerative medicine and bioengineering. The next generation of biologically compatible implants, capable of treating spinal damage, will become a reality thanks to the implementation of 3D printing in hospitals as an alternative to current techniques.
Statements
Acknowledgements
The authors of this paper would like to thank the involvement of the coordinating and teaching staff of the “Producción y traducción de artículos científicos biomédicos (III ed.)” and the “Traducción inversa de artículos científicos biomédicos (español-inglés)” courses, as well as the English translation team.
Conflicts of interests
The authors declare no conflict of interest.
References
- Artificial discs for lumbar and cervical degenerative disc disease -update: an evidence-based analysis. Ont Health Technol Assess Ser. 2006;6(10):1–98.
- Ravindra VM, Senglaub SS, Rattani A, Dewan MC, Härtl R, Bisson E, et al. Degenerative Lumbar Spine Disease: Estimating Global Incidence and Worldwide Volume. Glob spine J. 2018;8(8):784–94.
- Bowles RD, Setton LA. Biomaterials for intervertebral disc regeneration and repair. Biomaterials. 2017;129:54–67.
- Hoy D, March L, Brooks P, Blyth F, Woolf A, Bain C, et al. The global burden of low back pain: estimates from the Global Burden of Disease 2010 study. Ann Rheum Dis. 2014;73(6):968–74.
- Kalichman L, Hunter DJ. Diagnosis and conservative management of degenerative lumbar spondylolisthesis. Eur spine J Off Publ Eur Spine Soc Eur Spinal Deform Soc Eur Sect Cerv Spine Res Soc. 2008;17(3):327–35.
- Cunin V. Early-onset scoliosis: current treatment. Orthop Traumatol Surg Res. 2015;101(1 Suppl):S109-18.
- Cho W, Job AV, Chen J, Baek JH. A Review of Current Clinical Applications of Three-Dimensional Printing in Spine Surgery. Asian Spine J. 2018;12(1):171–7.
- Hunziker EB, Lippuner K, Keel MJB, Shintani N. An educational review of cartilage repair: precepts & practice–myths & misconceptions–progress & prospects. Osteoarthr Cartil. 2015;23(3):334–50.
- Lippincott Williams & Wilkins. Histology for pathologists. MILLS S, editor. 2019.
- Sheha ED, Gandhi SD, Colman MW. 3D printing in spine surgery. Ann Transl Med. 2019;7(Suppl 5):S164.
- Burnard JL, Parr WCH, Choy WJ, Walsh WR, Mobbs RJ. 3D-printed spine surgery implants: a systematic review of the efficacy and clinical safety profile of patient-specific and off-the-shelf devices. Eur Spine J [Internet]. 2020;29(6):1248–60. Disponible en: https://doi.org/10.1007/s00586-019-06236-2
- Bonhome-Espinosa AB, Campos F, Durand-Herrera D, Sánchez-López JD, Schaub S, Durán JDG, et al. In vitro characterization of a novel magnetic fibrin-agarose hydrogel for cartilage tissue engineering. J Mech Behav Biomed Mater. 2020;104:103619.
- Álvarez E, Ripoll PL, Restrepo A, Forriol F. Revisión de la reparación del cartílago. Posibilidades y resultados. Trauma (Spain). 2010.
- Kalamchi L, Valle C. Embryology, Vertebral Column Development. In Treasure Island (FL); 2021.
- Roberts S, Evans H, Trivedi J, Menage J. Histology and pathology of the human intervertebral disc. J Bone Joint Surg Am. 2006;88 Suppl 2:10–4.
- Urban JPG, Roberts S. Degeneration of the intervertebral disc. Arthritis Res Ther. 2003;5(3):120–30.
- Caldwell KL, Wang J. Cell-based articular cartilage repair: the link between development and regeneration. Osteoarthr Cartil. 2015;23(3):351–62.
- Kolios G, Moodley Y. Introduction to stem cells and regenerative medicine. Respiration. 2013;85(1):3–10.
- Daly AC, Freeman FE, Gonzalez-Fernandez T, Critchley SE, Nulty J, Kelly DJ. 3D Bioprinting for Cartilage and Osteochondral Tissue Engineering. Adv Healthc Mater. 2017;6(22).
- Cui H, Nowicki M, Fisher JP, Zhang LG. 3D Bioprinting for Organ Regeneration. Adv Healthc Mater. 2017;6(1).
- Jamróz W, Szafraniec J, Kurek M, Jachowicz R. 3D Printing in Pharmaceutical and Medical Applications – Recent Achievements and Challenges. Pharm Res. 2018;35(9):176.
- Liaw CY, Guvendiren M. Current and emerging applications of 3D printing in medicine. Biofabrication. 2017.
- Anderl H, Zur Nedden D, Mühlbauer W, Twerdy K, Zanon E, Wicke K, et al. CT-guided stereolithography as a new tool in craniofacial surgery. Br J Plast Surg. 1994;47(1):60–4.
- Widmer MS, Gupta PK, Lu L, Meszlenyi RK, Evans GR, Brandt K, et al. Manufacture of porous biodegradable polymer conduits by an extrusion process for guided tissue regeneration. Biomaterials. 1998;19(21):1945–55.
- Haggerty J, Cima M, Williams P, inventores; Sachs E, titular. (1993). Técnicas de Impresión Tridimensional. Patente Estadounidense. 5,204,055 04/28/1993.
- Richter DL, Schenck RCJ, Wascher DC, Treme G. Knee Articular Cartilage Repair and Restoration Techniques: A Review of the Literature. Sports Health. 2016;8(2):153–60.
- Sabino MA, Loaiza M, Dernowsek J, Rezende R, Da Silva JVL. Técnicas para la fabricación de andamios poliméricos con aplicaciones en ingenierÍa de tejidos. Rev Latinoam Metal y Mater. 2017.
- Vijayavenkataraman S, Yan W-C, Lu WF, Wang C-H, Fuh JYH. 3D bioprinting of tissues and organs for regenerative medicine. Adv Drug Deliv Rev. 2018;132:296–332.
- Huang Y, Zhang XF, Gao G, Yonezawa T, Cui X. 3D bioprinting and the current applications in tissue engineering. Biotechnology Journal. 2017.
- D’Urso PS, Williamson OD, Thompson RG. Biomodeling as an aid to spinal instrumentation. Spine (Phila Pa 1976). 2005;30(24):2841–5.
- Moroni L, Boland T, Burdick JA, De Maria C, Derby B, Forgacs G, et al. Biofabrication: A Guide to Technology and Terminology. Trends Biotechnol. 2018;36(4):384–402.
- Elkasabgy NA, Mahmoud AA. Fabrication Strategies of Scaffolds for Delivering Active Ingredients for Tissue Engineering. AAPS PharmSciTech. 2019;20(7):256.
- Sun J, Vijayavenkataraman S, Liu H. An Overview of Scaffold Design and Fabrication Technology for Engineered Knee Meniscus. Mater (Basel, Switzerland). 2017;10(1).
- Siu TL, Rogers JM, Lin K, Thompson R, Owbridge M. Custom-Made Titanium 3-Dimensional Printed Interbody Cages for Treatment of Osteoporotic Fracture-Related Spinal Deformity. World Neurosurg. 2018;111:1–5.
- Choy WJ, Mobbs RJ, Wilcox B, Phan S, Phan K, Sutterlin CE 3rd. Reconstruction of Thoracic Spine Using a Personalized 3D-Printed Vertebral Body in Adolescent with T9 Primary Bone Tumor. World Neurosurg. 2017;105:1032.e13-1032.e17.
- Liu B, Wang Z, Lin G, Zhang J. Radiculoplasty with reconstruction using 3D-printed artificial dura mater for the treatment of symptomatic sacral canal cysts: Two case reports. Medicine (Baltimore). 2018;97(49):e13289.
- Fricain JC, De Olivera H, Devillard R, Kalisky J, Remy M, Kériquel V, et al. Impression 3D en médecine régénératrice et ingénierie tissulaire. Médecine/Sciences. 2017; 33 (1) 52-59.
- Zhu W, Ma X, Gou M, Mei D, Zhang K, Chen S. 3D printing of functional biomaterials for tissue engineering. Current Opinion in Biotechnology. 2016.
- O’Brien CM, Holmes B, Faucett S, Zhang LG. Three-Dimensional Printing of Nanomaterial Scaffolds for Complex Tissue Regeneration. Tissue Eng Part B Rev [Internet]. 2015;21(1):103–14.
- Roseti L, Cavallo C, Desando G, Parisi V, Petretta M, Bartolotti I, et al. Three-Dimensional Bioprinting of Cartilage by the Use of Stem Cells: A Strategy to Improve Regeneration. Mater (Basel, Switzerland). 2018;11(9).
- Apelgren P, Amoroso M, Lindahl A, Brantsing C, Rotter N, Gatenholm P, et al. Chondrocytes and stem cells in 3D-bioprinted structures create human cartilage in vivo. PLoS One. 2017;12(12):e0189428.
- Láinez Ramos AJ, Rivera Izquierdo M. Synthesis and characterization of a cartilage model using hydroxyapatite, chitosan and polycaprolactone. Actual Medica. 2017;102(800):7–12.
- Duchi S, Onofrillo C, O’Connell CD, Blanchard R, Augustine C, Quigley AF, et al. Handheld Co-Axial Bioprinting: Application to in situ surgical cartilage repair. Sci Rep. 2017;7(1):5837.
- Shim JH, Lee JS, Kim JY, Cho DW. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. J Micromechanics Microengineering. 2012;
- Cui X, Breitenkamp K, Finn MG, Lotz M, D’Lima DD. Direct human cartilage repair using three-dimensional bioprinting technology. Tissue Eng Part A. 2012;18(11–12):1304–12.
- Lopa S, Mondadori C, Mainardi VL, Talò G, Costantini M, Candrian C, et al. Translational Application of Microfluidics and Bioprinting for Stem Cell-Based Cartilage Repair. Stem Cells Int. 2018;2018:6594841.
- Żylińska B, Silmanowicz P, Sobczyńska-Rak A, Jarosz Ł, Szponder T. Treatment of Articular Cartilage Defects: Focus on Tissue Engineering. In Vivo. 2018;32(6):1289–300.
- Rivera-Izquierdo M, Cabeza L, Láinez-Ramos-Bossini A, Quesada R, Perazzoli G, Alvarez P, et al. An updated review of adipose derived-mesenchymal stem cells and their applications in musculoskeletal disorders. Expert Opin Biol Ther. 2019;19(3):233–48.
- Martelli N, Serrano C, van den Brink H, Pineau J, Prognon P, Borget I, et al. Advantages and disadvantages of 3-dimensional printing in surgery: A systematic review. Surgery. 2016;159(6):1485–500.
- Mouser VHM, Levato R, Bonassar LJ, D’Lima DD, Grande DA, Klein TJ, et al. Three-Dimensional Bioprinting and Its Potential in the Field of Articular Cartilage Regeneration. Cartilage. 2017;8(4):327–40.
AMU 2021. Volumen 3, Número 1
Fecha de envío: Fecha de aceptación: Fecha de publicación:
14/03/2021 04/04/2021 31/05/2021
Cita el artículo: López-Gómez P, González-Alcaide M. Tecnologías de impresión 3D en ingeniería tisular para la reparación de patologías degenerativas de columna. AMU. 2021; 3(1):136-155
