Álvarez-Yepes, V. ¹ ² ³ †; Martín García, Raquel ¹ † *
¹ Facultad de Medicina, Universidad de Valladolid, 7, 47005 Valladolid, Castilla y León, España
² Hospital Universitario Reina Sofía de Murcia, 30003 Murcia, España
³ Hospital Clínico Universitario Virgen de la Arrixaca, 30120 El Palmar, Murcia, España
* Autor de correspondencia: raquel.martin.garcia@estudiantes.uva.esmiguelarajim@correo.ugr.es
† Ambas autoras han contribuido de manera igualitaria a la realización de este trabajo.
Resumen
La membrana amniótica (MA) se ha convertido en una herramienta terapéutica fundamental en la patología oftálmica, especialmente para abordar el tratamiento de diferentes patologías de la superficie ocular. Sus múltiples propiedades, antiinflamatorias, antimicrobianas, antifibróticas y antiangiogénicas, la hacen una opción muy efectiva en el manejo de enfermedades oculares. Extraída de la placenta, la MA es estructuralmente avascular y rica en factores de crecimiento y citoquinas, los cuales favorecen la regeneración celular y la cicatrización de heridas. En este artículo se revisa el papel actual que la MA representa como una alternativa valiosa en el tratamiento de diversas patologías oculares, subrayando su efectividad, ventajas y el impacto positivo en la recuperación de la salud visual. Las propiedades de la MA han aportado una eficaz solución para el tratamiento de diferentes enfermedades oculares. En el campo corneal la MA se usa para el tratamiento quirúrgico de úlceras, perforaciones corneales y síndrome del ojo seco. Además, su uso se ha extendido a la patología conjuntival, como en las conjuntivitis cicatriciales o las reconstrucciones de grandes defectos quirúrgicos. En el ámbito vítreo-retiniano, la MA ha demostrado resultados esperanzadores en el manejo de agujeros maculares. La preparación y aplicación de la MA incluye técnicas como la criopreservación, liofilización y deshidratación, lo que permite su conservación y uso en diversas condiciones clínicas. Se ha establecido como una opción terapéutica clave en la oftalmología reconstructiva y la regeneración de tejidos gracias a su capacidad para mejorar la epitelización y facilitar la reparación de la superficie ocular.
Palabras clave: Membrana amniótica; agujero macular; Tumor conjuntival; Regeneración celular; Cicatrización de heridas; Trasplante de membrana amniótica.
Abstract
The amniotic membrane (AM) has become a fundamental therapeutic tool in the field of ophthalmology, particularly in the treatment of various ocular surface disorders. Its multiple properties—anti-inflammatory, antimicrobial, antifibrotic, and antiangiogenic—make it a highly effective option for managing ocular diseases. Derived from the placenta, the AM is structurally avascular and rich in growth factors and cytokines, which promote cellular regeneration and wound healing. This article reviews the current role of the AM as a valuable alternative in the treatment of ocular pathologies, highlighting its effectiveness, advantages, and positive impact on visual health recovery. The beneficial properties of the AM have provided an effective solution for treating a range of eye conditions. In the corneal field, AM is used surgically to treat corneal ulcers, perforations, and dry eye syndrome. Its use has also expanded to conjunctival disorders, proving effective in treating conjunctivitis and pterygium. In the vitreoretinal area, promising results have been observed in the management of macular holes. The preparation and application of AM involve techniques such as cryopreservation, lyophilization, and dehydration, allowing it to be preserved and utilized under various clinical conditions. Due to its ability to enhance epithelialization and promote ocular surface repair, AM has become a key therapeutic option in reconstructive ophthalmology and tissue regeneration.
Keywords: Amniotic membrane; Macular hole; Conjunctival tumor; Cellular regeneration; Wound healing; Amniotic membrane transplantation.
1. Introducción
A nivel mundial, las enfermedades que afectan a la superficie ocular, como las úlceras corneales, el síndrome de ojo seco severo, el pterigión y algunos cuadros infecciosos o autoinmunes, constituyen una causa significativa de morbilidad ocular y de pérdida de visión que se podría evitar (1,2). Estas condiciones no sólo tienen un impacto negativo en la calidad de vida de los pacientes, sino que también representan un reto económico considerable en los sistemas de salud, debido al coste de los tratamientos, cirugías y seguimientos clínicos prolongados que conllevan (3). A pesar de los avances en tratamientos, muchas de estas patologías presentan recurrencias, complicaciones inflamatorias y recuperaciones visuales deficientes. Esto resalta la necesidad de desarrollar estrategias terapéuticas que sean más efectivas y regenerativas (4,5). En este contexto, la MA se ha convertido en una herramienta terapéutica valiosa en oftalmología que permite tratar diversas enfermedades y condiciones que afectan a la superficie ocular. Gracias a sus propiedades, antiinflamatorias, antifibróticas, antiangiogénicas, antimicrobianas y regenerativas, la convierten en una opción terapéutica efectiva para una amplia variedad de patologías oftalmológicas (4,5).
Con este fin, se plantea si el uso de la MA en enfermedades oculares puede realmente mejorar la cicatrización de la superficie ocular y, al mismo tiempo, preservar una mejor función visual en comparación con las terapias tradicionales. El objetivo de este artículo es revisar las propiedades biológicas de la MA, describir sus métodos de preparación y analizar sus principales aplicaciones clínicas en el tratamiento de diversas patologías de oculares (4,5).
2. La Membrana Amniótica
2.1. Propiedades
La MA es una capa biológica delgada y resistente que recubre el interior de la placenta. Está compuesta por una delgada capa de células epiteliales, una membrana basal y un estroma de células mesenquimales. Es una estructura avascular y se nutre, por tanto, del líquido amniótico, el corion y los vasos sanguíneos fetales. Sus factores de crecimiento y citoquinas le confieren unas propiedades excepcionales que son utilizadas en el campo de la regeneración tisular y la cicatrización de heridas. Estas propiedades son (4):
- Antiinflamatorias: inhibición de la producción de citoquinas proinflamatorias con la consiguiente reducción de la inflamación.
- Antimicrobianas: actividad contra patógenos, lo que la hace útil en el tratamiento contra infecciones.
- Regeneración celular: favorece la epitelización y la reparación de la superficie epitelial.
- Inhibición de la fibrosis y de neovasos: reduce la formación de cicatrices y la creación de vascularización anormal.
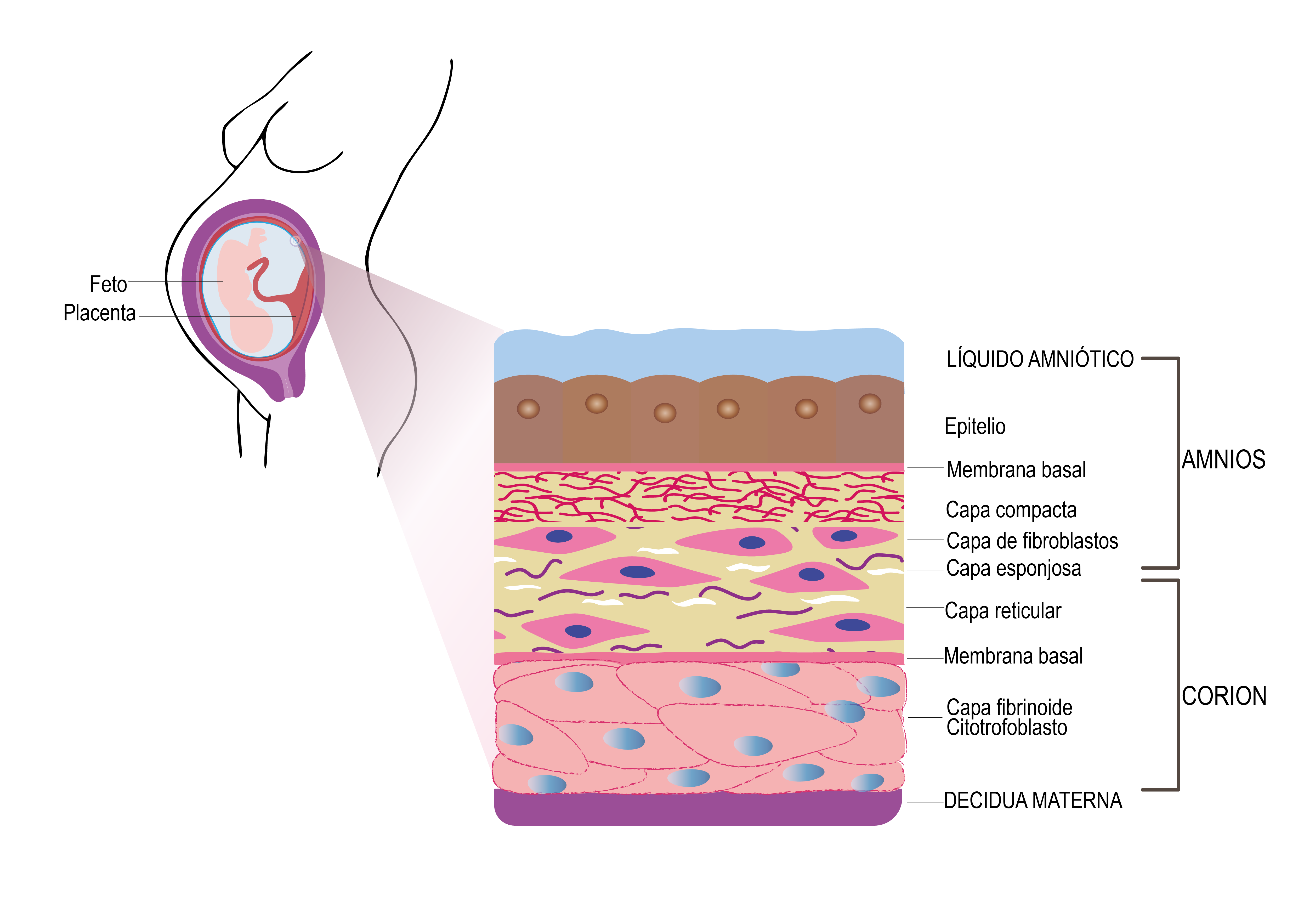
La MA proporciona propiedades físicas y gracias a su composición, favorece la migración de células epiteliales y su diferenciación y adhesión (Figura 1), lo que promueve la epitelización ordenada (4).
Figura 1. Estructura histológica de la MA y su relación con la placenta. Se representan las principales capas de la MA (epitelio, membrana basal, estroma compacto, fibroblastos, capa esponjosa y capa reticular), su conexión con el corion y la decidua materna. Elaboración propia.
2.2. Obtención
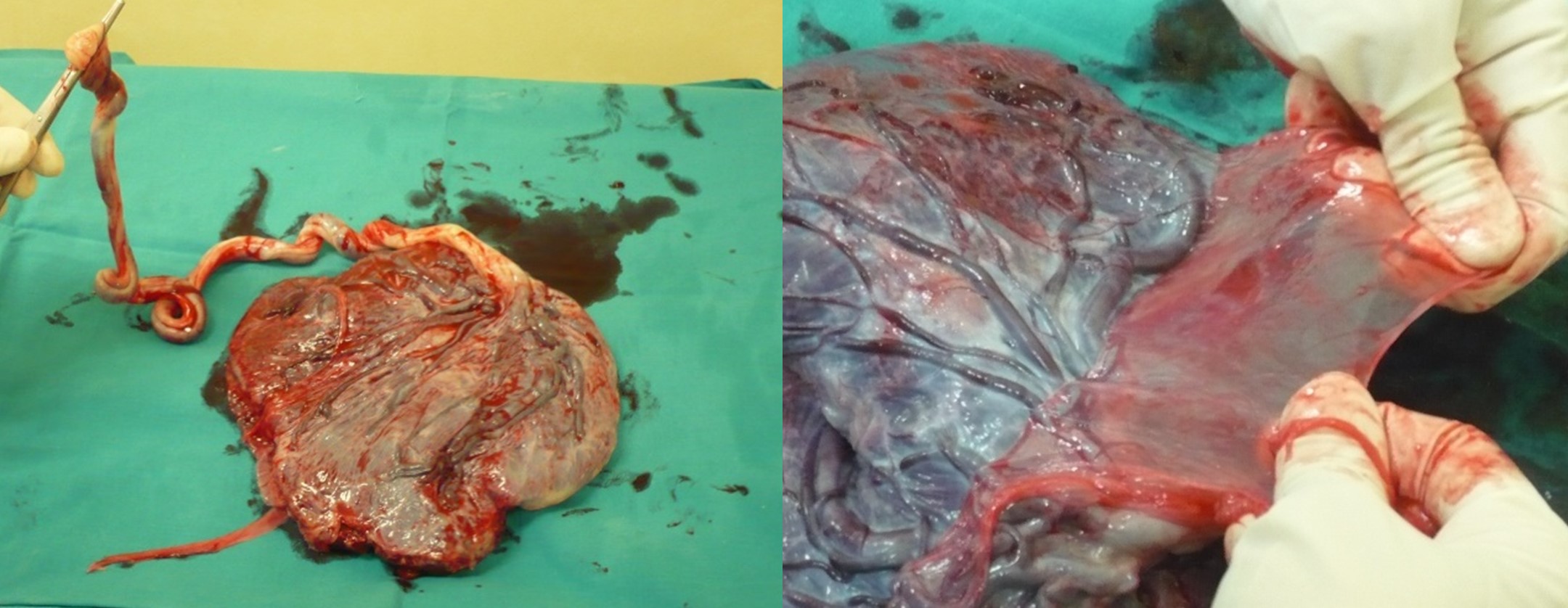
La MA se obtiene de placentas humanas en partos por cesárea, siguiendo rigurosos protocolos éticos y de bioseguridad. Las donantes son seleccionadas tras un cribado serológico para asegurarse de que no haya infecciones transmisibles, y tras previo consentimiento informado. La placenta se limpia con solución salina fisiológica para eliminar cualquier resto de sangre y coágulos, y luego se separa con mucho cuidado el amnios del corion mediante una disección en condiciones asépticas. (Figura 2). Posteriormente, se decide cómo preparar el tejido amniótico, ya sea para su conservación o su uso clínico, dependiendo de si se opta por criopreservación, liofilización, deshidratación o formulación en gotas (5,6).
Figura 2. Izquierda. Placenta humana recién extraída tras cesárea electiva, dispuesta sobre el campo estéril. De esta estructura se obtiene posteriormente la de MA para su uso clínico en diversas patologías. Derecha. Proceso de disección manual de la MA a partir de la placenta humana, utilizando técnica aséptica. Esta MA será posteriormente procesada para su uso terapéutico.
2.3. Preparación del tejido amniótico
- Criopreservación: método tradicional más utilizado. Consiste en sumergir la MA en una solución crioprotectora, usualmente dimetilsulfóxido (DMSO), en combinación con medios de cultivo, y almacenarla a temperaturas de −80°C, preservando todas sus propiedades biológicas (1,3).
- Liofilización: se elimina el contenido acuoso al congelar la MA mediante sublimación en un ambiente de vacío, consiguiendo un producto seco y estable a temperatura ambiente. Es ideal para el almacenamiento y transporte inmediato. Aunque algunas propiedades biológicas pueden verse afectadas, la MA liofilizada mantiene su estructura y puede rehidratarse antes de ser utilizada clínicamente (4,8).
- Deshidratación: se elimina la humedad de la MA con ayuda de protectores como azúcares que sustituyen el agua intracelular y resguardan las estructuras celulares, utilizando calor por medio de una deshidratación térmica. Puede haber una pérdida parcial de las propiedades biológicas de la MA al utilizar calor. Conseguimos una membrana ligera y fácil de manejar, ideal para aplicaciones rápidas (9).
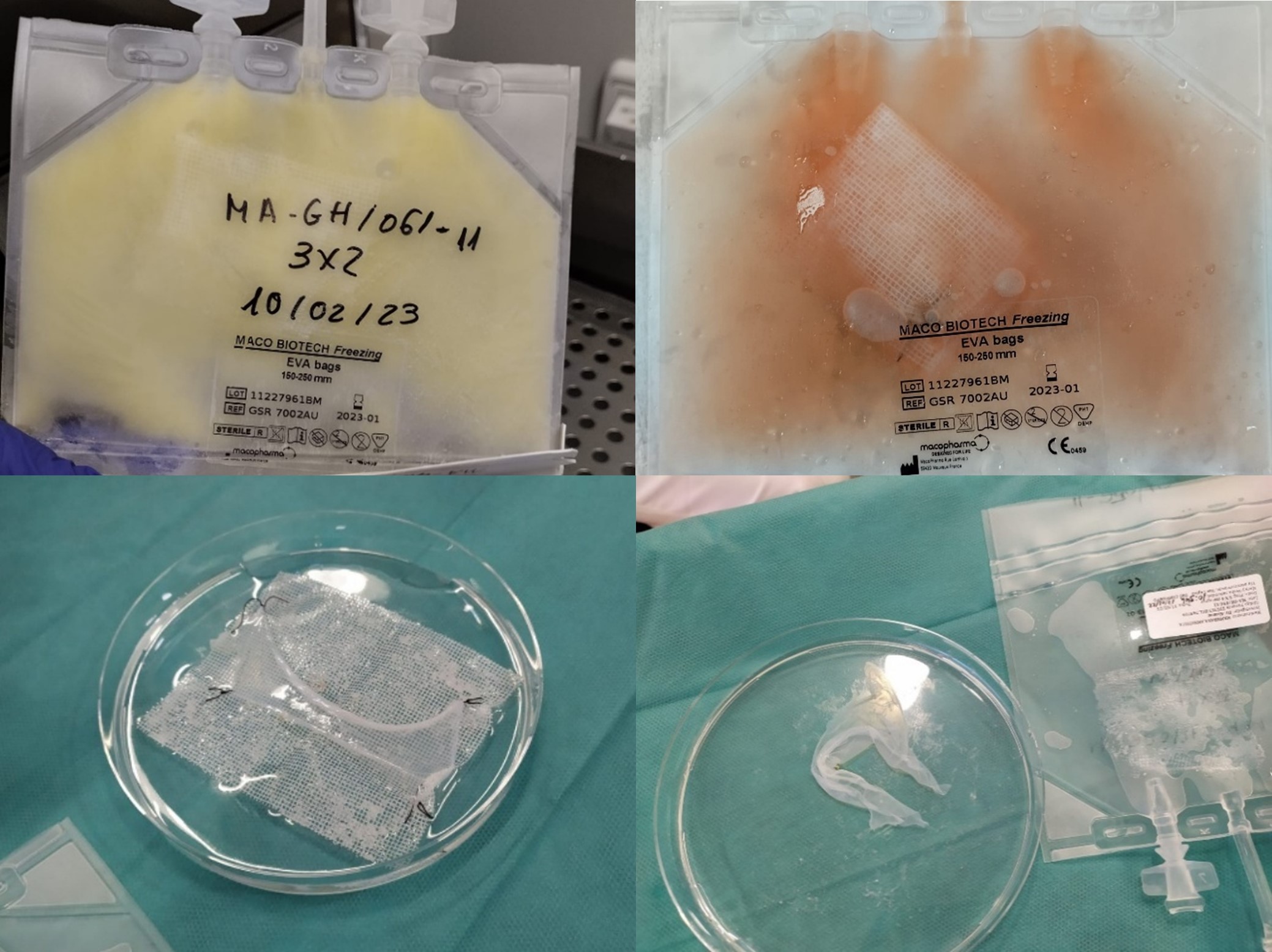
- Formulación en gotas: gotas oftálmicas que provienen de extractos de MA. Se obtiene lavando la MA con suero salino estéril, homogeneizarla y filtrar el extracto para así conseguir un líquido que conserve las propiedades de la MA, con concentrado de factores de crecimiento. Es una opción terapéutica menos invasiva para patologías de superficie ocular (10–12) (Figura 3).
Figura 3. Superior izquierda. MA conservada a -80°C mediante criopreservación, envasada en condiciones estériles. Se observa el aspecto de la MA congelada antes del proceso de descongelación controlada, paso indispensable previo a su uso clínico. Superior derecha. MA procesada mediante criopreservación, sumergida en solución crioprotectora compuesta por dimetilsulfóxido (DMSO) y medio de cultivo. Inferior izquierda. MA descongelada sobre una placa Petri, suturada a una malla de Linitul® con cuatro puntos simples para facilitar su manipulación durante la aplicación quirúrgica. Inferior derecha. Aspecto de la MA descongelada tras el lavado con solución salina para eliminar los restos de DMSO. A su lado, otra unidad de MA descongelada, en su envase estéril debidamente rotulado.
2.4. Formas de administración de la MA
- Técnicas de sutura directa a la superficie ocular: en el tratamiento quirúrgico, el injerto de MA se sutura directamente sobre la superficie ocular, mediante diversas técnicas realizadas según localización, naturaleza de la lesión y objetivo terapéutico. La MA se aplica de forma localizada, o como un parche, cubriendo áreas extensas de la córnea, donde se integra con el área lesionada y promueve la cicatrización (13).
- Uso de MA deshidratada con lentes de contacto terapéuticas: el uso de la MA deshidratada en combinación con lentes de contacto terapéuticas constituye una técnica no invasiva y eficaz en el tratamiento de patologías de superficie ocular. Gris et al.(14), evidencian que esta técnica combinada favorece la regeneración epitelial y reduce la inflamación en casos de defectos persistentes del epitelio corneal. De forma más reciente, Travé-Huarte et al. (15), probaron la efectividad clínica del sistema Omnigen ® (NuVision Biotherapies Ltd., Nottingham, UK), en la enfermedad ocular seca, donde se encontraron importantes evidencias de mejoras en los síntomas y la estabilidad lagrimal sin necesidad de suturas.
- MA deshidratada (seca): la MA en su forma deshidratada puede emplearse de manera independiente o junto a dispositivos terapéuticos, como en el estudio de Linsey (16), donde se combina un parche de presión palpebral durante 24 horas en pacientes con defectos epiteliales corneales persistentes.
- Uso de gotas oftálmicas de MA: una alternativa más actual y menos invasiva de administración de la MA es su aplicación tópica en forma de colirio de gotas, AMEED (Amniotic Membrane Extract Eye Drops). Esta formulación aprovecha las propiedades de la MA sin necesidad de cirugía, aplicando la formulación líquida directamente sobre la superficie ocular. Estudios retrospectivos como el de Pérez et al. (11), han evaluado la eficacia y seguridad del uso de AMEED en pacientes con enfermedad ocular seca y lesiones epiteliales persistentes, evidenciando una reducción significativa de signos y síntomas clínicos, junto con la restauración de la integridad del epitelio corneal. No se observaron eventos adversos relevantes y se mostró una buena tolerancia al tratamiento, emergiendo como una prometedora estrategia terapéutica en patologías de difícil manejo.
- MA fresca: diversas investigaciones respaldan la efectividad terapéutica de la MA en su forma fresca, resaltando la conservación total de sus propiedades biológicas. Uno de los estudios en los que se fundamenta este campo es realizado por Shimazaki et al. (17), donde la MA en fresco proporciona beneficios en el manejo de quemaduras oculares. A su vez, Chugh et al. (18), realizaron una comparación directa entre la MA fresca y la preservada en pacientes con deficiencia parcial de células madre limbares, revelando un eficacia clínica comparable entre ambas formas de administración. Del mismo modo y de forma más reciente, en un metaanálisis desarrollado por Hu et al. (19), se analizó la eficacia de ambas presentaciones de MA, concluyendo que, aunque ambas resultan efectivas, la forma fresca podría conservar mejor ciertos factores biológicos.
- MA en Hidrogel: el empleo de la MA en forma hidrogel es una alternativa destinada a resolver las limitaciones de las modalidades convencionales de aplicación de la MA, como la variabilidad biológica y la complejidad quirúrgica en su manipulación. Esta estrategia permite desarrollar sistemas de liberación prolongada y matrices bioactivas que se ajusten a la superficie del ojo (20). Se ha desarrollado una formulación en hidrogel a base de MA bajo GMP que asegura tanto la seguridad como la consistencia del producto en su uso clínico, proporcionando soporte estructural y liberación de componentes bioactivos de la MA (21). El reciente trabajo de Basasoro et al (20) analizó el potencial terapéutico de hidrogeles enriquecidos con proteínas de origen amniótico humano en la reparación de heridas corneales revelando que estos biomateriales favorecen la retención de fármacos y estimulan la regeneración del epitelio corneal.
- Inyección o Implantes de MA (Partículas o Polvo): una forma innovadora de administración de la MA consiste en su procesamiento en formato micronizado o liofilizado, lo que permite su uso como polvo, partículas o suspensión inyectable. Elkhenany et al. (22) señalan que esta nueva presentación mejora la estabilidad, el almacenamiento y la facilidad de uso, actuando además como sistema de liberación prolongada que funciona como un reservorio nanoestructurado capaz de liberar factores bioactivos de manera sostenida.
Una vez explicado todo el proceso de obtención, preparación y administración de la MA, procedemos a explicar sus diferentes usos en el campo de la Oftalmología (Tabla 1).
3. Aplicaciones de MA en patología corneal
3.1. Úlceras y perforaciones corneales
El empleo de MA en úlceras corneales persistentes y perforaciones representa una de sus aplicaciones más destacadas en oftalmología. Varios estudios preclínicos han demostrado su eficacia y seguridad en estas patologías (1). En quemaduras térmicas y químicas se ha visto que es realmente útil cuando se trata de casos severos, en los que hay una pérdida de epitelio. Por lo tanto, en estos casos, resulta muy beneficioso para promover la reepitelización y reducción de la inflamación aguda tras la quemadura ocular. Conseguimos así reducir las secuelas cicatriciales y las posibles deformidades, y maximizar los resultados del tratamiento (1). En la fase aguda de las causticaciones oculares graves, la MA proporciona ventajas en cuanto a alivio rápido del dolor y reepitelización (1) y ha demostrado beneficios al disminuir la inflamación y al promover la regeneración epitelial frente a terapias estándar (24).
La superficie ocular se reconstruye aplicando parches de MA o como injertos de incrustación, fijados con suturas reabsorbibles. El injerto debe exceder en al menos 1 mm el tamaño del defecto, con las suturas dispuestas alrededor del borde y los nudos enterrados en el epitelio corneal. Por todo ello, en el tratamiento de úlceras corneales y defectos epiteliales persistentes, la MA ha demostrado una capacidad superior para promover la reepitelización, reducir la inflamación, mejorar la visión y evitar las recurrencias en comparación con tratamientos convencionales locales como lentes de contacto terapéuticas o suero autólogo; y sistémicos (25,26).
3.2. Herpes ocular
El herpes ocular es una infección provocada por el virus del herpes simple tipo 1 y 2 que afecta principalmente al epitelio corneal, aunque puede comprometer estructuras más profundas. La lesión epitelial más frecuente es la úlcera. El tratamiento se centra en el uso de antivirales tópicos y/o sistémicos como el aciclovir o el ganciclovir, que ayudan a controlar la replicación viral. En sus formas más severas, como la queratitis estromal o neurotrófica, el riesgo de cicatrización, pérdida visual y perforación es alto. En estos casos, el injerto de MA ha demostrado ser una opción terapéutica muy efectiva. Según Drozhzhyna et al. (27), han demostrado que el trasplante de MA en casos de queratitis por herpes simple ayuda a la reepitelización corneal, reduce la inflamación ocular y mejora la agudeza visual, evitando complicaciones graves como la perforación. El injerto de MA actúa como apósito biológico para la migración de células epiteliales, modulando la respuesta inflamatoria y creando una barrera protectora contra agentes externos (27).
3.3. Patología inflamatoria
La queratitis ulcerosa periférica (QUP, en inglés PUK), es un trastorno inflamatorio que afecta a la córnea yuxtalimbar y que cursa con lisis estromal y lesiones epiteliales. Se trata de una urgencia médica pues, sin tratamiento, puede llevar a una perforación corneal (28). Cuando la QUP no cursa con afectación sistémica se denomina Úlcera de Mooren (UM) (28). La UM es un trastorno crónico raro, de etiología desconocida, que generalmente comienza en la córnea periférica y va progresando centrípetamente hacia el centro (25). Para su tratamiento se ha probado a utilizar la MA en casos de afectación corneal severa. En la UM, en concreto, cuyo tratamiento es complicado, se utilizó la técnica quirúrgica del “sándwich”, la cual permitió la conservación de la córnea y redujo la probabilidad de aparición de glaucoma (25).
3.4. Estrabismo
El estrabismo restrictivo es un problema que puede aparecer tras cualquier cirugía periocular debido al desarrollo de fibrosis inducida por la manipulación de tejidos durante el procedimiento quirúrgico. En las cirugías del estrabismo, son cada vez más los casos en los que se obtienen numerosos beneficios utilizando la MA para evitar y tratar las complicaciones restrictivas. Se utiliza la técnica del “wrap”, que consiste en recubrir el músculo extraocular con la MA, proporcionando una envoltura extra y separándolo de los tejido adyacentes, evitando que aparezca fibrosis (29). En seres humanos se han conseguido resultados muy prometedores con MA criopreservada. Sin embargo, preparaciones de MA liofilizada no mostraron beneficio y se desaconsejó su utilización en estas cirugías. Por lo que, en casos complicados de estrabismo restrictivo, esta técnica se considera una buena opción (29).
3.5. Síndrome ojo seco
El Síndrome de Ojo Seco tiene una alta prevalencia en la población y constituye una de las mayores morbilidades oculares. El tratamiento se lleva a cabo en función de la gravedad de cada caso y su cronicidad. Uno de los hallazgos más destacables de los estudios llevados a cabo, es el efecto que la MA tiene en la regeneración de los nervios corneales y la recuperación acelerada de la superficie ocular, lo que lleva a un alivio del dolor más precoz (3). Voigt et al.(3) llevaron a cabo una comparación entre el uso de MA y la ciclosporina A tópica para tratar el síndrome de ojo seco moderado a severo. En pacientes que no respondían a otros tratamientos, algunos lograron mantener la superficie ocular estable durante varios meses, aunque otros experimentaron recurrencias. En los casos moderados a graves, la MA como tratamiento complementario mostró mejoras significativas en un plazo de tres meses. También se notó una rápida disminución del dolor en pacientes con dolor corneal neuropático agudo, con una baja necesidad de reimplantación. Por último, el análisis de costes reveló que la MA fue más efectiva y menos costosa en el 91,5% de los casos (3). Cabe destacar que, el Síndrome de Ojo Seco es en ocasiones la primera manifestación de la Enfermedad de Injerto contra Huésped (EICH), desarrollando estos pacientes rápidamente un ojo seco severo. En estos casos, la MA vuelve a ser un buen recurso para tratar el ojo seco severo debido a EICH por sus propiedades antiinflamatorias y anti-cicatriciales (30).
3.6. Queratopatía bullosa
La queratopatía ampollosa o bullosa es una enfermedad degenerativa que provoca acumulación de líquidos en las capas externas de la córnea formando bullas o ampollas. Este edema corneal por fallo endotelial puede originarse como complicación de cirugías oculares y distrofias corneales y suele ser causa de trasplante corneal. Las ampollas rotas causan dolor intenso, visión borrosa, fotofobia y sensación de cuerpo extraño. En el estudio clínico prospectivo realizado por Stefaniu et al. (31,32), que incluyó a 42 pacientes operados entre enero de 2009 y 2013; se evaluó el efecto de la MA en la reepitelización corneal, las bullas epiteliales, la recurrencia del dolor y la fotofobia. Los resultados mostraron mejora de síntomas en 37 pacientes, desaparición completa en 29, persistencia mínima en 8 y ausencia de mejora en 5, donde los síntomas reaparecieron tras la reabsorción de la MA. Llegando a la conclusión de que la utilización de la MA es una forma efectiva de brindar cuidado paliativo en casos de queratopatía ampollosa (31,32).
3.7. Apoyo al trasplante de córnea
El trasplante de córnea o queratoplastia es un procedimiento que reemplaza la córnea enferma por una sana proveniente de un donante. Este tipo de cirugía se realiza para mejorar la visión en pacientes con opacidades o distrofias o ectasias corneales. Existen distintos tipos de queratoplastia, y un paciente que se somete a una queratoplastia necesitará un tiempo más o menos prolongado de recuperación, dependiendo del tipo de procedimiento llevado a cabo. La MA es una herramienta útil como adyuvante en el trasplante de córnea, especialmente en situaciones de alto riesgo o daño severo en la superficie ocular. Según Zatarain-Barrón et al. (33), el uso de injertos de MA en la cirugía corneal ayuda a estabilizar el lecho receptor y favorece una reepitelización más rápida reduciendo las complicaciones postoperatorias. En diversas revisiones clínicas (2,34), se resalta que la MA crea un entorno antiinflamatorio, antifibrótico y antiangiogénico que protege el injerto corneal de una respuesta inmunitaria excesiva, mejorando las tasas de éxito del trasplante. Su uso se considera seguro, con bajo riesgo de efectos adversos y mejores resultados anatómicos y funcionales a largo plazo en pacientes que tienen factores de riesgo para el rechazo.
3.8. Trasplantes de repetición
Los trasplantes de repetición de córnea, también conocidos como regrafts, son procedimientos que se deben a injertos corneales que fracasan por causas como el rechazo inmunológico, la disfunción endotelial o las infecciones. Estos caso muestran una disminución progresiva en la tasa de supervivencia del injerto y un mayor riesgo de complicaciones. Nguyen et al. (35), en su estudio sobre el uso de la MA en queratoplastias penetrantes de alto riesgo, incluyendo los regrafts, señalan que la aplicación de MA favorece la cicatrización y protege al injerto frente a tratamientos convencionales. Sin embargo, los autores subrayan la necesidad de estudios adicionales que respalden estos resultados a largo plazo.
3.9. La deficiencia de células madre limbales (LSDC)
La LSDC es una enfermedad degenerativa que afecta la superficie ocular debido a la pérdida o daño de las células madre del limbo esclerocorneal, encargadas de regenerar el epitelio corneal. Esta condición provoca inflamación crónica, opacidad en la córnea, neovascularización y pérdida progresiva de la visión. La MA es una herramienta clave en el tratamiento de la LSDC, especialmente combinada con trasplantes celulares, actuando como sustrato que estimula el crecimiento y la expansión epitelial. Gracias a sus propiedades, promueve la reepitelización corneal y mejora la adherencia de las células madre trasplantadas, creando un entorno más estable y menos hostil para los injertos celulares oculares. En combinación con la terapia inmunosupresora, especialmente con trasplantes alogénicos en LSDC bilaterales, la MA ayuda a mitigar la reacción inmunitaria, mejorando los resultados quirúrgicos. Aunque no sustituye al trasplante de células madre limbares, la MA potencia la eficacia de las terapias regenerativas destinadas a restaurar la superficie ocular en la LSDC.
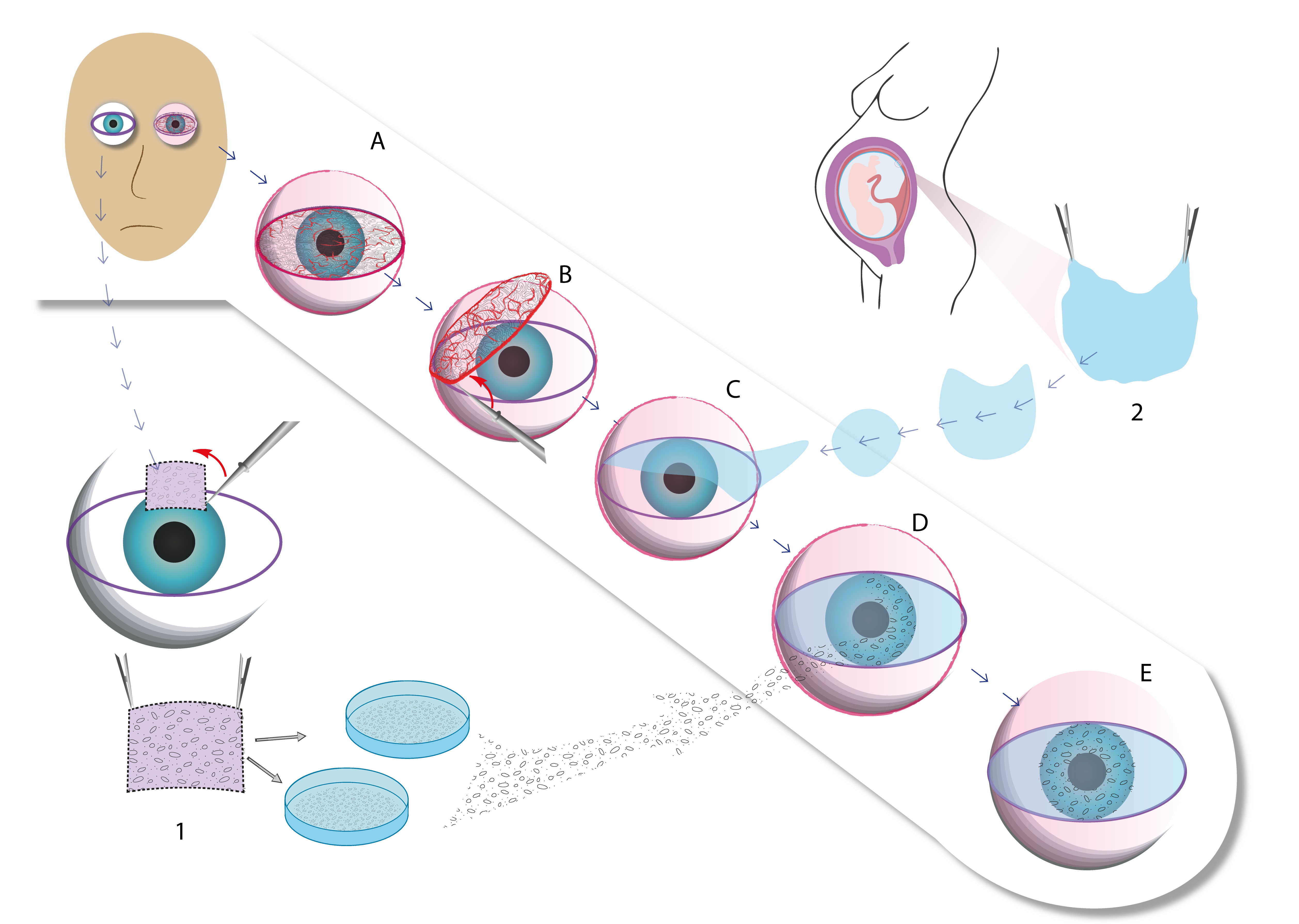
El trasplante de epitelio limbar simple (SLET) es una técnica quirúrgica desarrollada para tratar la LSDC, especialmente en casos unilaterales (Figura 4). La SLET consiste en tomar pequeñas biopsias del limbo del ojo sano del paciente y transferirlas a una MA, que luego se coloca sobre la córnea del ojo afectado. Combinada con la MA, esta técnica ha demostrado mejorar significativamente la recuperación ocular, especialmente en pacientes con LSDC unilateral. No solo es una técnica menos invasiva, sino que también optimiza la restauración de la superficie ocular al promover una mejor integración y expansión de las células madre, acelerando así la reepitelización de la córnea (36).
Figura 4. Representación esquemática de la técnica SLET (\textit{Simple Limbal Epithelial Transplantation}) para el tratamiento de la deficiencia de células madre limbares (LSCD). En el paciente con afectación unilateral, se extrae un pequeño fragmento de limbo del ojo sano (donante autólogo), que se cultiva sobre soporte adecuado (1). A. Ojo afectado por LSCD, con presencia de pannus fibrovascular.
B. Escisión del pannus y del epitelio conjuntivalizado tras peritomía de 360°. C. Colocación de la MA como soporte sobre la superficie corneal ya preparada. 2. Obtención de la MA a partir de placenta humana donada. D. Implantación de los fragmentos de limbo autólogo directamente sobre la MA. E. Resultado del ojo tras la colocación de la MA y los fragmentos de células madre limbares. Elaboración propia.
3.10. Queratopatía en banda
La queratopatía en banda (QB) es una patología ocular degenerativa que se manifiesta por el depósito de calcio en las capas superficiales de la córnea, lo que genera opacidad, dolor y disminución de la agudeza visual. Los tratamientos convencionales contemplan procedimientos como la quelación con EDTA, el raspado mecánico o la queratectomía fototerapéutica, los cuales, aunque efectivos, no están exentos de complicaciones como dolor postoperatorio, cicatrización lenta y recurrencias frecuentes (37). A diferencia de los tratamientos tradicionales, la MA tras la eliminación de los depósitos cálcicos en la córnea ofrece ventajas significativas, demostrando ser beneficiosa en la recuperación corneal, disminuyendo significativamente el dolor y permitiendo una cicatrización más rápida (38).
3.11. Distrofia de membrana basal
La distrofia de membrana basal epitelial (EBMD) es una alteración del epitelio corneal caracterizada por la presencia de irregularidades en forma de pliegues o microquistes y defectos en la adhesión celular, lo que favorece la aparición de erosiones recurrentes y provoca molestias oculares dolorosas y alteraciones visuales. El tratamiento abarca desde medidas conservadoras como el uso de lubricantes y lentes de contacto blandas, hasta intervenciones como el desbridamiento epitelial. En Yeu et al. (39), estudiaron la aplicación de MA criopreservada tras el desbridamiento epitelial en pacientes con EBMD programados para cirugía de catarata. Frente a lentes terapéuticas, la MA mostró una mayor reepitelización y recuperación postoperatoria, sin interferir con la calidad visual, ni la cirugía programada. Si bien los hallazgos son alentadores, aún se precisan de estudios más amplios para confirmar su eficacia en comparación con los tratamientos convencionales.
4. La Membrana Amniótica
4.1. SSJ y espectro de eritema multiforme
El síndrome de Stevens-Johnson (SSJ), así como la necrólisis epidérmica tóxica son entidades graves del espectro del eritema multiforme, el cual incluye desde formas leves con lesiones autolimitadas hasta cuadros severos caracterizadas por una reacción inmunológica intensa con potencial compromiso sistémico. Estas formas graves afectan la piel y las mucosas, comprometiendo la superficie ocular y ocasionando complicaciones visuales. Frente a los tratamientos convencionales, hidratación ocular, antibióticos y corticoides, la MA se perfila como una terapia regenerativa que demuestra su utilidad reduciendo la inflamación, y conservando la integridad ocular. Gracias a sus propiedades antiinflamatorias y regenerativas, actúa como soporte biológico obteniendo mejores resultados y reduciendo las complicaciones. La MA no solo actúa como complemento a las terapias tradicionales, sino que en muchos casos, ofrece una mayor eficacia y mejor pronóstico ocular a largo plazo (40).
4.2. Conjuntivitis
La MA se ha utilizado con éxito en la conjuntivitis leñosa. Se trata de una afección crónica, rara, en la que se produce el desarrollo de pseudomembranas ricas en fibrina firmemente adheridas a la conjuntiva tarsal. A pesar de las múltiples opciones de las que se dispone para su tratamiento (heparina con corticoides tópicos, tratamiento inmunosupresor o plasminógeno tópico), el pronóstico no es bueno. Actualmente, se ha probado a tratar esta patología mediante trasplantes de MA y tratamiento adyuvante con ciclosporina A tópica y se ha observado que, la MA favorece la reepitelización y reduce la inflamación y la cicatrización, consiguiendo un resultado bastante favorable (41).
4.3. Tumores conjuntivales
Uno de los principales usos de la MA en patología conjuntival son los tumores de conjuntiva, especialmente los tumores de la conjuntiva epibulbar. En el estudio realizado por Furdova A. et al. (42) se trató al 11,1% de los pacientes, que tenían tumores malignos, con injertos de MA tras la escisión quirúrgica de la lesión (42). No se documentaron casos de recurrencias en el periodo de 30 meses en los tumores epibulbares no melanóticos y; los resultados estéticos y funcionales fueron favorables en la mayoría de los casos (42). Se llegó de esta forma a la conclusión de que los injertos de MA resultan una buena alternativa terapéutica para cubrir los defectos postquirúrgicos de la escisión de gran tamaño y conseguir buenos resultados estéticos (42,43).
En el caso de lesiones benignas de la conjuntiva como es el pterigión, también se ha utilizado la MA. En el pterigión se produce un crecimiento fibrovascular triangular desde el canto nasal hacia la córnea, ocasionando un aplanamiento del eje horizontal de la córnea y pudiendo llegar a invadir el eje pupilar. Shimazaki et al. (44), analizaron el uso combinado de MA y autoinjerto limbal en pacientes que sufrían de pterigión recurrente severo asociado a simbléfaron. En cuatro pacientes, tras la resección del tejido cicatricial y la aplicación de la MA y autoinjerto limbal, se logró la eliminación completa del simbléfaron, con mejoría de la movilidad ocular y estabilización de la superficie ocular. La MA funcionó como sustrato biológico que facilitó la reepitelización, redujo la inflamación y fibrosis, mientras que el autoinjerto limbal proporcionó las células madre para la regeneración corneal. Este enfoque quirúrgico demostró ser eficaz y seguro al restaurar tanto la anatomía como la función de la superficie ocular (44). Por lo que, en estos casos de elevada recurrencia, la MA es una alternativa útil en procedimientos donde el autoinjerto conjuntival, considerado gold-estándar en esta patología, presenta limitaciones, como en pacientes con escasa conjuntiva o en situaciones de recurrencias múltiples (45). Asimismo, un metaanálisis reciente en el que se comparan estrategias combinadas de MA y fármaco, mostró que la combinación de MA con mitomicina C ofrece tasas de recurrencia similares y menor inflamación postoperatoria en algunos casos (46).
5. Aplicaciones de MA en patología vítreo-retiniana: Agujeros maculares
El agujero macular es un defecto completo en la fóvea que ocasiona pérdida de la visión central, metamorfopsia y, en etapas más avanzadas, escotoma central. Es consecuencia de traumatismos, miopías patológicas, desprendimientos de retina o por causas seniles (47–49). Varios estudios han puesto de manifiesto la efectividad de la MA como opción terapéutica para tratar agujeros maculares persistentes o refractarios, especialmente cuando las técnicas convencionales fallan. El uso de la MA como injerto o apósito facilita el cierre anatómico del agujero macular, ayudando a regenerar las capas externas de la retina y mejorando la agudeza visual (47–49). En una revisión publicada por Caporossi T. et al (49), se resaltó la capacidad de la MA para integrarse subretinianamente y estimular la reconstrucción de la membrana limitante externa y la zona elipsoide (49). Asimismo, un estudio en pacientes con miopía magna y desprendimiento de retina tras cirugía fallida mostró que la cobertura con MA facilitó la reabsorción del desprendimiento y el cierre completo del agujero macular sin complicaciones significativas (48). Finalmente, un análisis retrospectivo en España confirmó la seguridad y eficacia del injerto de MA, logrando un cierre anatómico completo y evidenciando una mejoría y estabilización de la agudeza visual (47).
Tabla 1. Aplicaciones clínicas de la MA en diversas patologías oculares. Se describen las principales indicaciones, formas de aplicación y beneficios terapéuticos. Elaboración propia.
| Patología | Aplicación de la MA | Beneficios principales |
| Úlceras y perforaciones corneales | Injerto de MA criopreservada o deshidratada | Promueve reepitelización, reduce inflamación y cicatrización |
| Quemaduras oculares y causticaciones (fase aguda) | Injerto de MA como apósito urgente | Disminuye inflamación, protege superficie ocular y estroma, favorece epitelización, reduce necrosis |
| Herpes ocular | Injerto de MA complementario a antivíricos | Favorece epitelización, reduce inflamación y fibrosis postherpética |
| Úlcera de Mooren / QUP | Técnica del “sándwich” con MA sobre córnea | Conserva la córnea, reduce inflamación y riesgo de glaucoma |
| Estrabismo | Técnica “wrap” con injerto de MA sobre músculo extraocular | Previene fibrosis postquirúrgica y mejora movilidad ocular |
| Síndrome de ojo seco severo y EICH agudo | Gotas de extracto de MA o injerto | Mejora la regeneración nerviosa y alivio precoz del dolor, promueve reparación tisular e inmunomodulación |
| Queratopatía bullosa | Injerto de MA como cuidado paliativo | Reducción de bullas, alivio del dolor y fotofobia |
| Apoyo al trasplante de córnea y trasplantes de repetición (regrafts) |
Cobertura temporal o apósito en cirugía Injerto de MA como refuerzo en queratoplastias de alto riesgo |
Protege córnea, mejora epitelización postquirúrgica y cicatrización, reduce inflamación y mejora supervivencia en casos de regrafts |
| Deficiencia de células madre limbales (LSCD) | Sustrato para trasplante celular | Facilita la expansión celular y control inmunológico |
| Queratopatía en banda | Injerto de MA tras eliminación de depósitos cálcicos | Reduce el dolor, mejora la cicatrización y acelera la recuperación corneal |
| Distrofia de membrana basal (EBMD) | Injerto de MA tras desbridamiento epitelial | Favorece la reepitelización y mejora la recuperación postoperatoria |
| SSJ y espectro de eritema multiforme | Injerto de MA como terapia de soporte en fase aguda | Reduce inflamación, conserva la integridad ocular y mejora el pronóstico visual a largo plazo |
| Conjuntivitis | Injerto de MA junto con inmunosupresores tópicos | Favorece reepitelización y disminuye formación de pseudomembranas |
| Tumores conjuntivales (resección) | Injerto de MA post-exéresis | Facilita cicatrización conjuntival y disminuye fibrosis |
| Pterigión | Injerto de MA + autoinjerto limbal | Previene recidiva, mejora movilidad ocular y anatomía |
| Simblefarón | Injerto de MA tras liberación quirúrgica | Previene recurrencia, favorece regeneración conjuntival y reduce fibrosis |
| Agujeros maculares persistentes | Injerto subretiniano de MA | Estimula cierre anatómico del agujero y mejora agudeza visual |
6. Limitaciones y perspectivas de futuro
Aunque se han evidenciado numerosos beneficios respecto a la utilización de la MA en patología ocular, hay que señalar la existencia de ciertas limitaciones tanto en esta revisión como en su práctica clínica. La variabilidad en los métodos de preparación y aplicación de la MA, así como en las indicaciones clínicas, complica la comparación directa entre los estudios y la posibilidad de generalizar y estandarizar los resultados (45,50). Además, la eficacia clínica de las propiedades biológicas de la MA puede verse afectada o comprometida por la heterogeneidad en la calidad del tejido donado, así como en las variaciones en su procesamiento y almacenamiento (45,51). En ciertas situaciones, la reabsorción precoz de la MA, el desplazamiento o una integración incompleta del injerto, pueden influir negativamente en los resultados clínicos, especialmente en patologías graves o en pacientes con inflamación ocular activa (52). Todo ello nos indica que es crucial llevar a cabo estudios clínicos aleatorios más amplios y controlados y contar con ensayos multicéntricos bien estructurados, que estandaricen los protocolos de preparación y aplicación de la MA y comparen las diferentes formas de MA para indicaciones específicas, como las úlceras corneales neurotróficas, las quemaduras químicas o las queratopatías inmunológicas (50,53,54), con el fin de optimizar y potenciar los resultados a largo plazo.
De cara al futuro, algunas de las líneas de investigación más prometedoras incluyen el desarrollo de la combinación de MA con la medicina regenerativa, utilizando células madre o factores de crecimiento específicos (50). Esto podría potenciar su eficacia regenerativa y abrir nuevas posibilidades en el tratamiento de enfermedades complejas. Además, sería interesante estudiar la aplicación de la MA en patologías de la retina y el nervio óptico, áreas clave para la visión, donde las opciones terapéuticas actuales son limitadas o no curan la enfermedad.
Otra vertiente en la investigación es la creación de formulaciones derivadas de la MA como extractos o gotas oftálmicas; una alternativa menos invasiva y accesible. No obstante, la ausencia de protocolos estandarizados para su preparación y conservación representa un obstáculo en su integración en la práctica clínica (45). En último lugar cabe destacar, el potencial de la MA como un vehículo o medio para la liberación controlada y sostenida de medicamentos en enfermedades inflamatorias oculares crónicas. Esta interesante estrategia busca aprovechar las propiedades biológicas y estructurales de la MA para administrar fármacos de forma localizada y controlada en el ojo, con la intención de mejorar la eficacia del tratamiento y reducir los efectos secundarios sistémicos (55,56). Por todo ello, será clave que la investigación futura se enfoque y centre en estandarizar métodos, explorar nuevas combinaciones terapéuticas y ampliar las indicaciones clínicas, con el objetivo de maximizar los beneficios de la MA en el campo de la oftalmología.
7. Conclusiones
La MA se ha convertido en una herramienta terapéutica fundamental para tratar diversas patologías oculares gracias a sus propiedades antiinflamatorias, antimicrobianas, antifibróticas y regenerativas. La evidencia actual respalda su efectividad en el tratamiento de enfermedades corneales, conjuntivales y vítreo-retinianas, promoviendo la regeneración en la epitelización, disminuyendo la inflamación y favoreciendo la recuperación de la visión. Las diferentes formas de preparación, criopreservada, liofilizada, deshidratada o en gotas, amplían sus aplicaciones clínicas y hacen que sea más accesible. Aunque los resultados son prometedores, será clave que la investigación futura se enfoque y centre en estandarizar métodos, explorar nuevas combinaciones terapéuticas y ampliar las indicaciones clínicas, con el objetivo de maximizar los beneficios de la MA en el campo de la oftalmología.
Declaraciones
Agradecimientos
Este trabajo se enmarca dentro del curso “Introducción a la publicación de artículos biomédicos”, organizado por el Departamento de Cirugía, Oftalmología, Otorrinolaringología y Fisioterapia de la Facultad de Medicina de la Universidad de Valladolid, a quienes extendemos nuestro sincero reconocimiento por brindarnos esta oportunidad de crecimiento académico y profesional.
Queremos expresar nuestra gratitud a todas las personas que han hecho posible la realización de este trabajo, especialmente a nuestro tutor, el Dr. Pablo Redruello, por su apoyo constante, su generosidad al compartir conocimientos y su compromiso en cada etapa del proceso. Su entusiasmo y dedicación han sido clave para despertarnos el interés por la investigación y por mostrarnos el valor del trabajo riguroso y bien fundamentado. También agradecemos a Mary Sol Álvarez Yepes, ilustradora de este artículo, por su talento y dedicación y por su capacidad para trasladar a imágenes las ideas surgidas a lo largo de todo el proceso de elaboración de este proyecto. De manera especial, queremos agradecer mutuamente el esfuerzo, la entrega y la capacidad de adaptación que cada una de nosotras ha demostrado a lo largo de este proceso. Trabajar en equipo ha supuesto un verdadero reto, pero también nos ha permitido crecer, superar dificultades y encontrar nuevas formas de colaboración. Nos agradecemos a nosotras mismas por la paciencia, la tolerancia y la perseverancia con la que hemos afrontado cada etapa de este proyecto, que ha sido tan exigente como enriquecedor.
Conflictos de interés
Las autoras declaran no tener ningún conflicto de intereses.
Financiación
Este trabajo no ha recibido financiación específica de agencias públicas, comerciales o sin ánimo de lucro.
Referencias
- Sangwan VS, Burman S, Tejwani S, Mahesh SP, Murthy R. Amniotic membrane transplantation: A review of current indications in the management of ophthalmic disorders. Indian J Ophthalmol. 2007;55(4):251.
- Walkden A. Amniotic Membrane Transplantation in Ophthalmology: An Updated Perspective. Clin Ophthalmol. 2020;14:2057-72.
- Voigt J. Cost utility analysis of cryopreserved amniotic membrane versus topical cyclosporine for the treatment of moderate to severe dry eye syndrome. Cost Eff Resour Alloc. 2020;18:56.
- Sanders FWB, Huang J, Alió Del Barrio JL, Hamada S, McAlinden C. Amniotic membrane transplantation: structural and biological properties, tissue preparation, application and clinical indications. Eye (Lond). 2024;38(4):668-79.
- Jirsova K, Jones GLA. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting—a review. Cell Tissue Bank. 2017;18(2):193-204.
- Stelling-Férez J, Puente-Cuadrado JM, Álvarez-Yepes V, Alcaraz S, Tristante E, Hernández-Mármol I, et al. Refrigerated amniotic membrane maintains its therapeutic qualities for 48 hours. Front Bioeng Biotechnol. 2024;12.
- Witt J, Grumm L, Salla S, Geerling G, Menzel-Severing J. Cryopreservation in a Standard Freezer: −28 °C as Alternative Storage Temperature for Amniotic Membrane Transplantation. J Clin Med. 2022;11(4):1109.
- Rodríguez-Ares MT, López-Valladares MJ, Touriño R, Vieites B, Gude F, Silva MT, et al. Effects of lyophilization on human amniotic membrane. Acta Ophthalmol. 2009;87(4):396-403.
- Doll T. A history of amniotic membrane use in eye care. Optometry Times. 2025;17(2):32.
- Agusti E, Martinez-Conesa EM, Perez ML, Sabater-Cruz N, Casaroli-Marano RP, Vilarrodona A. A new step on amniotic membrane extract eye drops (AMEED) development for the treatment of severe ocular surface pathologies. BMJ Open Ophthalmol. 2022;7(Suppl 2):A13.
- Pérez ML, Barreales S, Sabater-Cruz N, Martinez-Conesa EM, Vilarrodona A, Casaroli-Marano RP. Amniotic membrane extract eye drops: a new approach to severe ocular surface pathologies. Cell Tissue Bank. 2022;23(3):473-81.
- Murri MS, Moshirfar M, Birdsong OC, Ronquillo YC, Ding Y, Hoopes PC. Amniotic membrane extract and eye drops: a review of literature and clinical application. Clin Ophthalmol. 2018;12:1105-12.
- Meller D, Pauklin M, Thomasen H, Westekemper H, Steuhl KP. Amniotic Membrane Transplantation in the Human Eye. Dtsch Arztebl Int. 2011;108(14):243-8.
- Gris O, del Campo Z, Wolley-Dod C, Güell JL, Bruix A, Calatayud M, et al. Amniotic Membrane Implantation as a Therapeutic Contact Lens for the Treatment of Epithelial Disorders. Cornea. 2002;21(1):22.
- Travé-Huarte S, Wolffsohn JS. Sutureless Dehydrated Amniotic Membrane (Omnigen) Application Using a Specialised Bandage Contact Lens (OmniLenz) for the Treatment of Dry Eye Disease: A 6-Month Randomised Control Trial. Medicina. 2024;60(6):985.
- Linsey K. Use of an Eyelid Pressure Patch Concomitantly with a Decellularized Dehydrated Amniotic Membrane for Ocular Surface Disease Management. Ophthalmol Ther. 2025;14(3):573-84.
- Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology. 1997;104(12):2068-76.
- Chugh JP, Jain P, Sen R. Comparative analysis of fresh and dry preserved amniotic membrane transplantation in partial limbal stem cell deficiency. Int Ophthalmol. 2015;35(3):347-55.
- Hu Y, Yu J, Fu Y, Guan X, Xiong F, Liao H, et al. Efficacy of Fresh Versus Preserved Amniotic Membrane Grafts for Ocular Surface Reconstruction: Meta-analysis. Tissue Eng Part B Rev. 2024;
- Basasoro A, Mendicute J, Rezola M, Burgos J, Fernández M, Esporrín-Ubieto D, et al. The influence of amniotic membrane proteins on corneal regeneration when delivered directly or using hydrogel platforms. Front Med. 2025;12:1498319.
- Barrera V, Rathbone S, Joseph A, Rooney P. Development of human amniotic membrane products for regenerative medicine applications. BMJ Open Ophth. 2022;7(Suppl 2).
- Elkhenany H, El-Derby A, Abd Elkodous M, Salah RA, Lotfy A, El-Badri N. Applications of the amniotic membrane in tissue engineering and regeneration: the hundred-year challenge. Stem Cell Research & Therapy. 2022;13(1):8.
- Velarde K, Arvonen A, Gonzalez T, Diller RB. A Biologic and Physical Characterization of an Injectable Amniotic Membrane Designed for Treating Diabetic Foot Ulcers. Bioengineering. 2024;11(11):1087.
- Kheirkhah A, Johnson DA, Paranjpe DR, Raju VK, Casas V, Tseng SCG. Temporary Sutureless Amniotic Membrane Patch for Acute Alkaline Burns. Archives of Ophthalmology. 2008;126(8):1059-66.
- Al Motowa S, Al Zobidi M. Amniotic Membrane Transplant with a Special Technique (Motowa’s Sandwich Technique) in Mooren’s Ulcer. Middle East Afr J Ophthalmol. 2015;22(3):386-8.
- Ciftci MD, Selver OB. Sandwich Technique and Amniotic Membrane Transplantation as an Effective Method in Repairing Corneal Perforations. Middle East African Journal of Ophthalmology. 2024;30(4):246.
- Drozhzhyna G, Vit V, Molchanuk N. Trasplante de membrana amniótica para el tratamiento de queratitis ulcerativa recurrente por virus herpes simple. Horizonte Médico (Lima). 2016;16(3):79-82.
- Fu L, Jones S. Peripheral Ulcerative Keratitis. En: StatPearls. Treasure Island (FL): StatPearls Publishing; 2025.
- Macías-Franco S, Costales-Álvarez C, Rozas-Reyes P. Doble recubrimiento con membrana amniótica en estrabismo restrictivo. Archivos de la Sociedad Española de Oftalmología. 2023;98(2):112-5.
- Ikarashi H, Aketa N, Shimizu E, Takano Y, Kawakita T, Uchino Y, et al. Two case reports of continued progression of chronic ocular graft-versus-host disease without concurrent systemic comorbidities treated by amniotic membrane transplantation. BMC Ophthalmol. 2021;21:164.
- Stefaniu GI, Chiotoroiu SM, Secureanu FA, Purcarea VL, Zemba M. Use of amniotic membrane in bullous keratopathy palliative care. J Med Life. 2014;7(Spec Iss 2):88-91.
- Chansanti O, Horatanaruang O. The results of amniotic membrane transplantation for symptomatic bullous keratopathy. J Med Assoc Thai. 2005;88 Suppl 9:S57-62.
- Zatarain-Barrón NC, Vera-Duarte GR, Velasco-Sepulveda B, Ramirez-Miranda A, Navas A, Garfias Y, et al. Surgical Outcomes of Amniotic Membrane Transplantation in Impending or Full-Thickness Corneal Perforation. Cornea Open. 2025;4(1):e0056.
- Chiu HI, Tsai CC. Self-Retained, Sutureless Amniotic Membrane Transplantation for the Management of Ocular Surface Diseases. J Clin Med. 2023;12(19):6222.
- Nguyen P, Rue K, Heur M, Yiu SC. Ocular surface rehabilitation: Application of human amniotic membrane in high-risk penetrating keratoplasties. Saudi J Ophthalmol. 2014;28(3):198-202.
- Shanbhag SS, Patel CN, Goyal R, Donthineni PR, Singh V, Basu S. Simple limbal epithelial transplantation (SLET): Review of indications, surgical technique, mechanism, outcomes, limitations, and impact. Indian J Ophthalmol. 2019;67(8):1265-77.
- Jhanji V, Rapuano CJ, Vajpayee RB. Corneal calcific band keratopathy. Current Opinion in Ophthalmology. 2011;22(4):283.
- Anderson DF, Prabhasawat P, Alfonso E, Tseng SCG. Amniotic Membrane Transplantation After the Primary Surgical Management of Band Keratopathy. Cornea. 2001;20(4):354.
- Yeu E, Hashem O, Sheha H. Treatment of Epithelial Basement Membrane Dystrophy to Optimize the Ocular Surface Prior to Cataract Surgery. Clin Ophthalmol. 2022;16:785-95.
- Ma KN, Thanos A, Chodosh J, Shah AS, Mantagos IS. A Novel Technique for Amniotic Membrane Transplantation in Patients with Acute Stevens-Johnson Syndrome. The Ocular Surface. 2016;14(1):31-6.
- Tok OY, Kocaoglu FA, Tok L, Burcu A, Ornek F. Treatment of ligneous conjunctivitis with amniotic membrane transplantation and topical cyclosporine. Indian J Ophthalmol. 2012;60(6):563-6.
- Furdova A, Czanner G, Koller J, Vesely P, Furda R, Pridavkova Z. Amniotic membrane application in surgical treatment of conjunctival tumors. Sci Rep. 2023;13(1):2835.
- Palamar M, Yaman B, Akalın T, Yağcı A. Amniotic Membrane Transplantation in Surgical Treatment of Conjunctival Melanoma: Long-term Results. Turk J Ophthalmol. 2018;48(1):15-8.
- Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br J Ophthalmol. 1998;82(3):235-40.
- Norte-Muñoz M, Botelho MF, Schoeberlein A, Chaves J, Neto Murta J, Ponsaerts P, et al. Insights and future directions for the application of perinatal derivatives in eye diseases: A critical review of preclinical and clinical studies. Front Bioeng Biotechnol. 2022;10.
- Taher NO, Alnabihi AN, Hersi RM, Alrajhi RK, Alzahrani RA, Batais WT, et al. Amniotic membrane transplantation and conjunctival autograft combined with mitomycin C for the management of primary pterygium: A systematic review and meta-analysis. Front Med. 2022;9.
- Gutierrez-Benitez L, Biarge G, Asaad M, Delas B. Injerto de membrana amniótica como tratamiento para agujeros maculares persistentes y miópicos. Nuestra experiencia. Archivos de la Sociedad Española de Oftalmología. 2025;100(4):213-8.
- Qiao G, Zhang XJ, Tang ZY, Zou QX, He CM, Lei XM, et al. Amniotic membrane for covering high myopic macular hole associated with retinal detachment following failed primary surgery. Int J Ophthalmol. 2022;15(5):760-5.
- Caporossi T, Tartaro R, Bacherini D, Pacini B, De Angelis L, Governatori L, et al. Applications of the Amniotic Membrane in Vitreoretinal Surgery. J Clin Med. 2020;9(8):2675.
- Lacorzana Rodríguez J. Evaluación de los efectos del uso de membrana amniótica en patología de la superficie ocular [doctoral thesis]. Universidad de Granada; 2023.
- Mamede AC, Carvalho MJ, Abrantes AM, Laranjo M, Maia CJ, Botelho MF. Amniotic membrane: from structure and functions to clinical applications. Cell Tissue Res. 2012;349(2):447-58.
- Sridhar U, Tripathy K. Amniotic Membrane Graft. En: StatPearls. Treasure Island (FL): StatPearls Publishing; 2025.
- Yang H, Li Z, Jin W, Yang A. Application progress of human amniotic membrane in vitreoretinopathy: a literature review. Front Med (Lausanne). 2023;10:1206577.
- Eslani M, Baradaran-Rafii A, Cheung AY, Kurji KH, Hasani H, Djalilian AR, et al. Amniotic Membrane Transplantation in Acute Severe Ocular Chemical Injury: A Randomized Clinical Trial. American Journal of Ophthalmology. 2019;199:209-15.
- Resch MD, Marsovszky L, Csányi E, Budai-Szűcs M, Németh J. Amniotic Membrane and the Controlled Drug Release. En: Mamede AC, Botelho MF, editores. Amniotic Membrane: Origin, Characterization and Medical Applications. Dordrecht: Springer Netherlands; 2015. p. 177-92.
- Resch MD, Resch BE, Csizmazia E, Imre L, Németh J, Révész P, et al. Permeability of Human Amniotic Membrane to Ofloxacin In Vitro. Investigative Ophthalmology & Visual Science. 2010;51(2):1024-7.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 01/03/2025
Fecha de revisión: 06/03/2025
Fecha de aceptación: 25/04/2025
Cita el artículo: Álvarez-Yepes V, Martín García R. Más allá de la placenta: usos de la membrana amniótica en la regeneración ocular. AMU. 2025;6(1):52-63.
URI: https://hdl.handle.net/10481/105373
