Morán Cerro, Andrea ¹; Vaz Cardoso, Júlia ² *
¹ Escuela de Doctorado Universidad de Valladolid
² Facultad de Medicina, Universidad de Valladolid
* Autor de correspondencia: juliavazpubli@gmail.com
Resumen
El síndrome de Dunbar, también denominado el síndrome del ligamento arcuato medio (SLAM) se caracteriza por una compresión extrínseca del tronco celíaco producida por el ligamento arcuato medio (LAM). A pesar de que su prevalencia estimada es baja, se sospecha que está infradiagnosticado debido a la alta proporción de personas con compresión anatómica sin sintomatología clínica. En cuanto a su fisiopatología, no se limita únicamente a la isquemia por compresión arterial, sino que también implica la afectación del plexo celíaco, provocando síntomas gastrointestinales. Por todo ello, su diagnóstico sigue siendo complejo, basándose en la exclusión de otras causas comunes de dolor abdominal. Requiere estudios invasivos o de alta exposición radiológica como el uso de la angiografía tomográfica computarizada y angiografía por resonancia magnética. Atendiendo al tratamiento, únicamente está indicado para pacientes que presenten síntomas junto con una confirmación radiológica de la compresión. Entre los tratamientos se encuentra la cirugía laparoscópica, siendo actualmente el abordaje de elección, aunque en algunos casos se requiere volver a intervenir. En el caso de la cirugía robótica es una alternativa bastante prometedora, presenta menores tasas de complicaciones postoperatorias, sin embargo, su disponibilidad y experiencia aún son limitadas. En conclusión, a pesar de su rareza, el síndrome de Dunbar debe ser considerado en el diagnostico diferencial del dolor abdominal crónico. Su identificación precoz es crucial, pudiendo aplicar el tratamiento más adecuado mejorando significativamente la calidad de vida de los pacientes.
Palabras clave: síndrome del ligamento arcuato medio, síndrome de Dunbar, compresión del tronco celíaco, dolor abdominal.
Abstract
Dunbar’s syndrome, also called the syndrome of the middle arcuate ligament (MALS), is characterized by extrinsic compression of the celiac trunk by the middle arcuate ligament (MAL). Although its estimated prevalence is low, it is suspected to be underdiagnosed due to the high proportion of individuals with anatomical compression without clinical symptoms. In terms of its pathophysiology, it is not only limited to ischemia due to arterial compression, but also involves involvement of the celiac plexus, leading to gastrointestinal symptoms. Therefore, its diagnosis remains complex, based on the exclusion of other common causes of abdominal pain. It requires invasive studies or high radiological exposure such as the use of computed tomographic angiography and magnetic resonance angiography. An emerging issue is the high frequency of psychiatric comorbidities associated with Dunbar syndrome, such as anxiety, depression and post-traumatic stress disorder. In terms of treatment, it is only indicated for patients presenting with symptoms together with radiological confirmation of compression. Treatment includes laparoscopic surgery, which is currently the approach of choice, although in some cases reoperation is required. In the case of robotic surgery, it is a promising alternative, with lower postoperative complication rates, but its availability and experience are still limited. In conclusion, despite its rarity, Dunbar syndrome should be considered in the differential diagnosis of chronic abdominal pain. Its early identification is crucial, and the most appropriate treatment can be applied to significantly improve the quality of life of patients.
Keywords: middle arcuate ligament syndrome, Dunbar syndrome, celiac trunk compression, abdominal pain.
1. Introducción
El síndrome de Dunbar, también conocido como síndrome del ligamento arcuato medio (SLAM) o síndrome de compresión de la arteria celíaca, se produce por la compresión continua de la arteria celíaca y/o plexo celíaco por parte del ligamento arcuato medio (LAM) (1–5). Esta compresión está relacionada con variaciones anatómicas individuales que predisponen a esta condición. No obstante, es probable que esté infradiagnosticada ya que hasta el 25% de la población presenta signos radiológicos de compresión sin haber sido diagnosticada clínicamente (7–9). Algunos de sus síntomas son dolor abdominal crónico, dolor epigástrico posprandial, pérdida de apetito, náuseas, vómitos y pérdida de peso, lo que se traduce en una peor calidad de vida para los pacientes. Sin embargo, gracias a los diferentes tratamientos se puede conseguir una remisión total de la sintomatología (10–14).
A pesar de que la compresión de la arteria celíaca ha sido descrita hace décadas (15), la literatura científica sobre este síndrome es limitada, con escasos artículos que aborden su fisiopatología, diagnóstico y manejo. Esta escasez de estudios ha contribuido a una falta de consenso sobre los mecanismos causantes del cuadro clínico, lo que dificulta tanto su diagnóstico como el desarrollo de tratamientos estandarizados (16,17). Por ello, es fundamental fomentar la investigación en este campo para mejorar el reconocimiento y el abordaje precoz de esta patología. Ante esta situación, este artículo tiene como objetivo realizar una revisión narrativa de la bibliografía existente en los últimos años sobre esta afección, visibilizando esta entidad clínica, profundizando en el conocimiento de sus distintas formas de presentación sintomática, con el fin de facilitar su reconocimiento precoz y evitar diagnósticos tardíos que comprometan la calidad de vida del paciente.
2. Material y métodos
Se ha llevado a cabo una revisión narrativa de la literatura científica con el objetivo de explorar el estado actual del conocimiento sobre el síndrome de Dunbar. La búsqueda bibliográfica se realizó en bases de datos electrónicas, principalmente MEDLINE vía PubMed, Scopus y Google Scholar. Fueron aplicados los siguientes criterios de búsqueda:
- Un periodo de publicación de los últimos 5 años (2020–2025).
- Los tipos de documentos: libros y documentos, revisiones sistemáticas y metaanálisis.
- Los términos de búsqueda principal: “Median Arcuate Ligament Syndrome”, “Celiac Artery Stenosis from Compression by Median Arcuate Ligament of Diaphragm”, “Celiac Artery Compression Syndrome”, “Celiac Trunk Compression Syndrome”, “Dunbar Syndrome”, “Syndrome, Dunbar”.
La selección de los artículos se realizó en base a la relevancia para el tema, priorizando estudios que abordaran aspectos clínicos, diagnósticos y terapéuticos del síndrome. Por otro lado, no se aplicaron restricciones de idioma.
3. Anatomía y fisiopatología
Este síndrome, cuya nomenclatura hace referencia directa a su fisiopatología, se debe al fenómeno de compresión del tronco celíaco (1). El eje celíaco está constituido por el tronco celíaco y sus principales ramas: la arteria hepática común, la arteria esplénica y la arteria gástrica izquierda. Desde el punto de vista anatómico, este tronco nace directamente de la aorta abdominal, justo por debajo del diafragma, habitualmente a nivel de la vértebra T12 (18). Sin embargo, en algunas personas puede tener una inserción más alta de lo habitual, lo cual lo posiciona más cerca del LAM, favoreciendo su compresión (Figura 1) (19).
Figura 1. Compresión extrínseca del tronco celíaco por parte del ligamento arcuato medio. De elaboración propia creada con BioRender®.
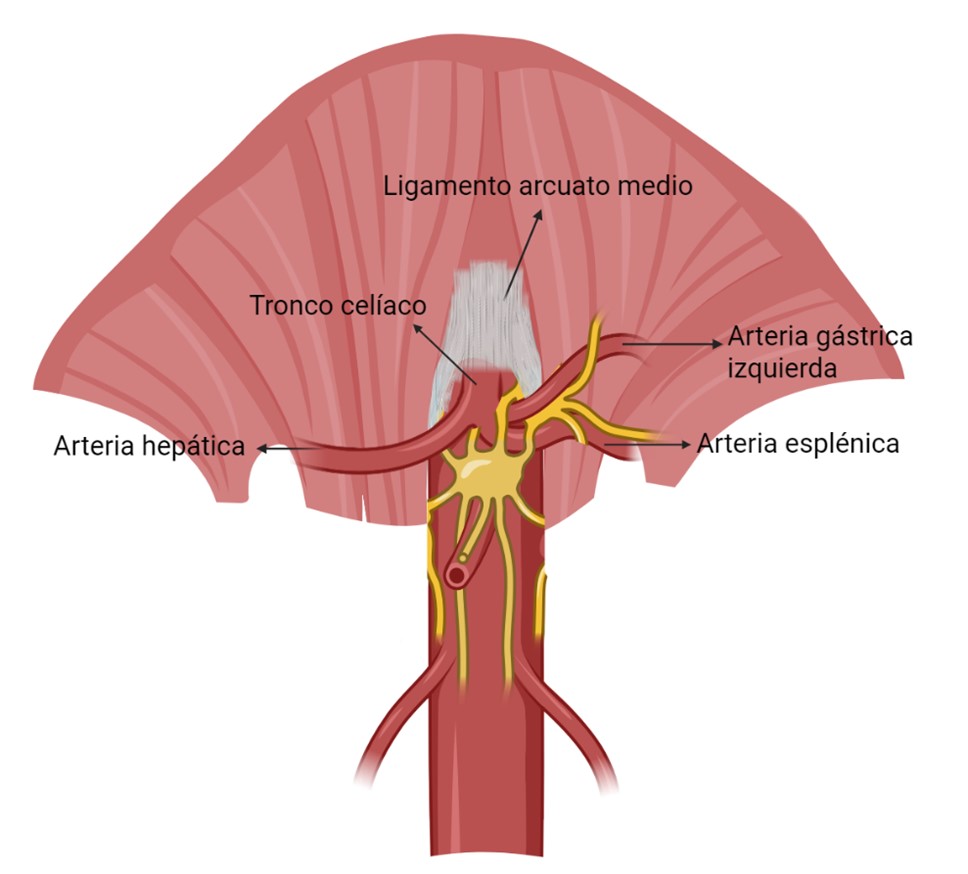
El LAM, es una estructura fibrosa que forma parte del hiato aórtico del diafragma. Se extiende desde el pilar derecho al izquierdo y cruza por encima de la aorta. En determinados casos, este ligamento puede estar engrosado o encontrarse insertado más caudalmente de lo normal, ejerciendo así una presión directa sobre el tronco celíaco. Se postula que su etiopatogenia está relacionada a alteraciones en el desarrollo embriológico (5). Sin embargo, esta compresión no es constante, sino que puede fluctuar con la dinámica respiratoria: tiende a intensificarse durante la espiración, cuando el LAM asciende, y a aliviarse con la inspiración, cuando el diafragma desciende, reduciendo la tensión sobre la arteria (20). También está descrito que esta compresión es más frecuente en mujeres, aunque no se sabe el motivo específico (18).
A pesar de que, en estudios de imagen, como en la angio-TC, se puede observar una compresión del tronco celíaco, la mayoría de los pacientes no presentan síntomas. Una explicación plausible es la existencia de una rica red de circulación colateral mesentérica, que puede suplir adecuadamente el flujo sanguíneo intestinal, incluso cuando el eje celíaco se encuentra parcialmente comprometido (7). Asimismo, en algunos casos se ha identificado estenosis significativa de la arteria celíaca como hallazgo asociado (21). El mecanismo de isquemia originado por el estrechamiento de la arteria celiaca causado por la compresión del LAM difiere del originado por la aterosclerosis, aunque en ambos casos se genera un flujo sanguíneo turbulento a través del vaso afectado (22,23). No obstante, en los casos sintomáticos, el cuadro clínico no se limita exclusivamente a la isquemia. En la proximidad del LAM se encuentra el plexo celíaco, compuesto por un conjunto de ganglios y una compleja red de fibras nerviosas, que incluye ramas de los nervios esplácnicos preganglionares, del nervio vago, fibras sensitivas viscerales del nervio frénico y fibras simpáticas posganglionares. La irritación o compresión de este plexo podría contribuir de forma importante a la clínica aun en ausencia de una causa obstructiva evidente (24).
4. Sintomatología
Esta afectación puede producir alteraciones en la motilidad gástrica, caracterizadas por un ritmo eléctrico gástrico anómalo y retraso en el vaciamiento gástrico, contribuyendo así al desarrollo de diversas manifestaciones digestivas en los pacientes afectados (5,25). Los pacientes con SLAM suelen presentar síntomas compatibles con isquemia del intestino anterior, entre los que se incluyen dolor epigástrico, dolor abdominal posprandial (26) o inducido por el ejercicio, náuseas, diarrea (27,28) y vómitos. Estas manifestaciones clínicas conducen frecuentemente a la aparición de aversión a la ingesta alimentaria y pérdida de peso (4,28,29).
Un campo en desarrollo es el estudio de la percepción de dolor y la calidad de vida de los pacientes de SLAM que puede verse afectada por factores como comorbilidades psiquiátricas. Estos datos están recogidos en estudios que evalúan la calidad de vida pre y postoperatoria de los pacientes (3,30). Entre las comorbilidades psiquiátricas más comúnmente observadas en pacientes con SLAM se encuentran los trastornos de ansiedad (6,31), la depresión (5), el trastorno de pánico (32) y el trastorno de estrés postraumático (21,23). Así mismo, los estudios concluyeron que los pacientes psiquiátricos presentaron una mejor calidad de vida tras la cirugía, sin embargo, no tuvo un impacto clínico relevante en la percepción del dolor (3,30). Por otro lado, se ha reportado una mayor prevalencia de otros trastornos caracterizados por anomalías físicas en pacientes con SLAM, tales como anormalidades vasculares viscerales, el síndrome de Ehlers-Danlos y el síndrome de taquicardia ortostática postural (34). Aunque la cirugía mejora los síntomas de dolor abdominal, náuseas y vómitos en la mayoría de los pacientes, muchos siguen experimentando un deterioro de su salud debido a las enfermedades subyacentes (3,34).
5. Diagnóstico
El diagnóstico del SLAM sigue siendo de exclusión y con frecuencia se alcanza tras el resultado de investigaciones exhaustivas. Esto suele implicar múltiples estudios de imagen dinámica, idealmente en fases de inspiración y espiración, para demostrar los cambios en el calibre arterial y correlacionarlos con la clínica (10). Dicha evaluación, es fundamental, dado que la gravedad de los síntomas es influenciada por estos cambios (35). Sin embargo, estos estudios a menudo son invasivos y conllevan a una alta exposición a la radiación. Antes de investigar el SLAM, se recomienda realizar una evaluación gastroenterológica completa con el objetivo de descartar causas más comunes de los síntomas del paciente. Para ello, la revisión gastroenterológica se debe incluir, una esofagogastroduodenoscopia, colonoscopia, estudios de motilidad gastrointestinal, pruebas de imagen transversales (como tomografía computarizada o resonancia magnética) y estudios hematológicos relevantes (28).
Debido al flujo turbulento generado por la estenosis (22,23), durante la exploración clínica, es posible detectar soplos abdominales en hasta un 35% de los pacientes con SLAM (30). Dentro de las modalidades de imágenes que se pueden utilizar para determinar el grado de compresión del tronco celíaco (3,16), se incluyen angiografía por tomografía computarizada (ATC), ecografía Doppler y angiografía por resonancia magnética (ARM) (Tabla 1).
Tabla 1. Ventajas y desventajas de las técnicas de imagen: Ecografía Doppler, Angiografía por tomografía computarizada y Angiografía por resonancia magnética. SLAM: síndrome del ligamento arcuato medio; LAM: síndrome del ligamento arcuato medio.
| Técnicas de imagen | Ventajas | Desventajas |
| Ecografía Doppler |
Falta de radiación ionizante y necesidad de contraste. Muestra la dilatación postestenótica y velocidades elevadas durante la espiración (2,36,41). Más económica y no invasiva. Detecta el ángulo de deflexión de la arteria celíaca, las velocidades del flujo arterial inspiratorio y en reposo (40). Puede determinar la presencia del signo del gancho, siendo buena técnica de construcción de imágenes preoperatorias (39). |
Depende del operador y necesita un operador experimentado para evaluar y mostrar los cambios. Está limitada por el hábito corporal y el gas intestinal suprayacente (2,41). Su efectividad puede verse reducida por ciertas variables, como la cantidad de aire en el intestino, pudiendo obstruir la captura de imágenes. Es necesario medir durante las fases respiratorias debido a su naturaleza cinética (39). |
| Angiografía por tomografía computarizada (ATC) |
Permite la visualización tridimensional de la arteria celíaca comprimida.Tiene alta resolución y puede mostrar cambios como la dilatación postestenótica y los aneurismas de la arteria visceral en comparación con la ecografía digital (8). Se obtienen rápidamente imágenes tridimensionales de las arterias mesentéricas, la posición del LAM. NO invasiva. Incluyen estrechamiento focal de la arteria celíaca proximal con una apariencia característica en forma de gancho (42). Permite apreciar el grado de colateralización que acompaña a la estenosis de la arteria celíaca. Esto puede ser de importancia clínica a la hora de predecir la respuesta del paciente al tratamiento (28). Se reproduce fácilmente y tiene una menor variación interobservador. No invasividad, la reconstrucción multiplanar de los planos arteriales con resolución detallada y la rápida obtención de imágenes (43). Determina el grado de estenosis a través de la fase arterial durante la espiración y la fase venosa durante la inspiración (40). |
Implica radiación ionizante y necesita contraste, lo que puede ser una limitación en pacientes con disfunción renal, además de inducir nefropatía (8). Los cambios en el calibre vascular y la velocidad del flujo con la respiración se aprecian más fácilmente (42). |
| Angiografía por resonancia magnética (ARM) |
Modalidad alternativa para aquellos pacientes que tienen alergia a los agentes de contraste intravenosos. No utiliza radiación ionizante (8). Es superior a la ecografía Doppler en determinadas circunstancias, como en el diagnóstico y la planificación preoperatoria de SLAM en poblaciones pediátricas (39). Utiliza la fase de la respiración para ayudar a calcular una imagen del tronco celíaco para medir el grado de estenosis (14). |
Además, la presencia del “signo del gancho” (un hallazgo radiológico clave para distinguir la compresión externa de la arteria por el LAM y el estrechamiento patológico del vaso debido a la aterosclerosis) no debe ser el único factor examinado en las imágenes, ya que el grado del ángulo creado por la desviación de la arteria celíaca también debe tenerse en cuenta en estos pacientes, donde el grado de desviación ascendente de la arteria es significativamente mayor y más severo que en individuos sin esta afección (31,37). De hecho, la medición precisa del grado de desviación de la arteria celíaca respecto a la aorta se considera, por lo tanto, un parámetro útil para establecer la gravedad de la compresión en pacientes con sospecha clínica de SLAM (38).
6. Tratamiento
El tratamiento quirúrgico está reservado exclusivamente para pacientes sintomáticos en los que se haya confirmado la compresión del tronco celíaco. Tradicionalmente, la cirugía abierta era la opción utilizada para el tratamiento, pero hoy en día ha sido desplazada por las técnicas mínimamente invasivas, siendo la cirugía laparoscópica la que se ha consolidado como el gold standard (35). La intervención consiste, en liberar el tronco celíaco seccionando LAM. En algunos casos puntuales, cuando se sospecha que los síntomas tienen un componente nervioso importante, también se puede resecar el plexo celíaco (16). Otra alternativa de cirugía mínimamente invasiva es la cirugía robótica, aunque todavía se considera una técnica relativamente nueva y con una importante curva de aprendizaje (22). Por este motivo, el número de casos descritos en la literatura sigue siendo limitado. La primera liberación robótica del LAM se describió en 2007 (23). Una de sus principales ventajas frente a la cirugía laparoscópica es la reducción en las tasas de complicaciones postoperatorias (19) (Tabla 2).
Tabla 2. Ventajas y desventajas de las técnicas de tratamiento: Cirugía abierta, Cirugía Laparoscópica y Cirugía Robótica.
| Técnica | Ventajas | Desventajas |
| Cirugía Abierta | Técnica establecida históricamente. Menor tasa de reintervención (6). | Más invasiva, mayor riesgo y recuperación más lenta. Más complicaciones perioperatorias (6). |
| Cirugía Laparoscópica |
Menor riesgo. Menor estancia hospitalaria (12). Menor dolor postoperatorio. Mejores resultados estéticos (29). |
Movimientos reducidos. Visión bidimensional, acceso y visión más limitada comparado con la abierta (22). |
| Cirugía Robótica |
Menores tasas de complicaciones postoperatorias (11). Visión tridimensional. Mayor precisión de movimientos (23). |
Alternativa emergente, con curva de aprendizaje prolongada (22). Alto coste (19). |
Una revisión sistemática analizó 38 estudios en adultos (880 pacientes) y 6 pediátricos (195 pacientes), encontrando que más del 70% de los pacientes experimentaron alivio sostenido de los síntomas tras la liberación quirúrgica del tronco celíaco (10). Aunque en muchos casos se logra una mejoría clínica significativa tras la intervención quirúrgica, no todos los pacientes evolucionan de forma favorable. Aquellos que no presentan mejoría pueden requerir una reintervención (6). En estos casos, se puede considerar el abordaje endovascular como una opción terapéutica secundaria, mediante técnicas como la angioplastia o la colocación de stents (39). Además, en determinadas situaciones, se ha propuesto una estrategia combinada de sección quirúrgica del LAM y tratamiento endovascular con el objetivo de reducir el riesgo de reestenosis (40). No obstante, el tratamiento endovascular no puede considerarse una opción terapéutica única, ya que la compresión extrínseca ejercida por LAM dificulta la adecuada expansión de la luz arterial, lo que limita la efectividad de las técnicas de angioplastia y colocación de stents (12). Por ello, es fundamental realizar primero la liberación quirúrgica de la compresión para garantizar mejores resultados (13).
7. Limitaciones
El trabajo presentado se corresponde con una revisión narrativa, de modo que no se ha llevado a cabo una búsqueda exhaustiva de toda la bibliografía disponible. En la estrategia de búsqueda en la base de datos PubMed no se ha aplicado un algoritmo sistemático, lo que puede limitar la precisión y la reproductibilidad de los resultados. Además, la selección de estudios se centró principalmente en los artículos publicados en los últimos cinco años, lo que podría inducir un sesgo de publicación reciente. Por otro lado, no se consultaron todas las bases de datos relevantes, lo que supone otra causa de sesgo. Por último, muchos de los estudios mencionados presentan una limitación debido a la no especificación en cuanto a la diversidad población en la cual realizan los estudios.
8. Conclusiones
El síndrome de Dunbar, o compresión del LAM, es una entidad clínica poco frecuente que probablemente esté infradiagnosticada. Este síndrome suele manifestarse con síntomas abdominales crónicos e inespecíficos, que impactan de forma importante en la calidad de vida de los pacientes. El diagnóstico, que muchas veces es de exclusión, exige un enfoque detallado y adaptado a cada caso. A pesar de las dificultades que todavía existen para diagnosticarlo, los tratamientos disponibles permiten la remisión de los síntomas en la mayoría de los pacientes, lo que refuerza la importancia de reconocerlo cuanto antes. Por todo esto, fomentar la investigación y mejorar la difusión del conocimiento sobre el síndrome de Dunbar es fundamental para optimizar tanto el diagnóstico como el tratamiento.
Declaraciones
Agradecimientos
Este trabajo surgió como consecuencia del curso “Introducción a la publicación de artículos biomédicos”, de la Universidad de Valladolid. Queremos expresar nuestro más sincero agradecimiento a nuestros tutores, Pablo Redruello Guerrero e Ignacio López Miñarro, por su dedicación, orientación y compromiso a lo largo de este proceso. Su acompañamiento ha sido fundamental para la realización de este de este proyecto.
Conflictos de interés
Los autores declaran no tener ningún conflicto de interés.
Financiación
Ninguna.
Referencias
- Zambrano-Lara M, Gonzalez-Urquijo M, Lozano-Balderas G, Rodarte-Shade M, Fabiani MA. Median arcuate ligament syndrome as a rare cause of chronic abdominal pain. Rev Gastroenterol Mex. 2021;86(2):199–201.
- Skeik N, Cooper LT, Duncan AA, Jabr FI. Median arcuate ligament syndrome: A nonvascular, vascular diagnosis. Vasc Endovascular Surg. 2011;45(5):433–7.
- Goodall R, Langridge B, Onida S, Ellis M, Lane T, Davies AH. Median arcuate ligament syndrome. J Vasc Surg. 2020;71(6):2170–6.
- Duffy AJ, Panait L, Eisenberg D, Bell RL, Roberts KE, Sumpio B. Management of median arcuate ligament syndrome: A new paradigm. Ann Vasc Surg. 2009;23(6):778–84.
- Upshaw W, Richey J, Ravi G, Chen A, Spillers NJ, Ahmadzadeh S, et al. Overview of Median Arcuate Ligament Syndrome: A Narrative Review. Cureus. 2023;15(10):e46675.
- DeCarlo C, Woo K, van Petersen AS, Geelkerken RH, Chen AJ, Yeh SL, et al. Factors associated with successful median arcuate ligament release in an international, multi-institutional cohort. J Vasc Surg. 2023;77(2):567-577.e2.
- Guazzo L, Lal V. Median arcuate ligament syndrome: When to consider the diagnosis and management options. Aust J Gen Pract. 2024;53(12):S28–32.
- Iqbal S, Chaudhary M. Median arcuate ligament syndrome (Dunbar syndrome). Cardiovasc Diagn Ther. 2021;11(5):1172–6.
- Barbon DA, Hsu R, Noga J, Lazzara B, Miller T, Stainken BF. Clinical Response to Celiac Plexus Block Confirms the Neurogenic Etiology of Median Arcuate Ligament Syndrome. J Vasc Interv Radiol. 2021;32(7):1081–7.
- Metz FM, Blauw JTM, Brusse-Keizer M, Kolkman JJ, Bruno MJ, Geelkerken RH. Systematic Review of the Efficacy of Treatment for Median Arcuate Ligament Syndrome. European Journal of Vascular and Endovascular Surgery. 2022;64(6):720–32.
- Smeu B, Dumbravã B, Nedelcu D, Bãnescu B, Bãilã S, Copãescu C. Robotic Approach for Median Arcuate Ligament Relief: A Case Report and Literature Review. Chirurgia (Romania). 2023;118(1):88–95.
- Do M V., Smith TA, Bazan HA, Sternbergh WC, Abbas AE, Richardson WS. Laparoscopic versus robot-assisted surgery for median arcuate ligament syndrome. Surg Endosc. 2013;27(11):4060–6.
- Baccari P, Civilini E, Dordoni L, Melissano G, Nicoletti R, Chiesa R. Celiac artery compression syndrome managed by laparoscopy. J Vasc Surg. 2009;50(1):134–9.
- Okobi OE, Boms MG, Ijeh JC, Eboigbe SE, Alex KB, Adejola AA, et al. Migraine and Current Pharmacologic Management. Cureus. 2022;14(10):e29833.
- Lipshutz B. A COMPOSITE STUDY OF THE CŒLIAC AXIS ARTERY. Ann Surg. 1917;65(2):159–69.
- Karanasios E, Ragab Z, Cavenagh H, Stather P, Ali T. Characteristics and Trends in Median Arcuate Ligament Syndrome (MALS) Associated Visceral Artery Aneurysms: A Systematic Descriptive Review of the Literature. Vasc Endovascular Surg. 2024;58(5):512–22.
- Giakoustidis A, Moschonas S, Christodoulidis G, Chourmouzi D, Diamantidou A, Masoura S, et al. Median arcuate ligament syndrome often poses a diagnostic challenge: A literature review with a scope of our own experience. World J Gastrointest Surg. 2023;15(6):1048–55.
- Dyches RP, Eaton KJ, Smith HF. The Roles of Celiac Trunk Angle and Vertebral Origin in Median Arcuate Ligament Syndrome. Diagnostics 2020, Vol 10. 2020;10(2):76.
- Gunjiganvi M, Marthandam S, Murugesan R, Palaniappan R. Feasibility and safety of robotic-assisted surgical approach in median arcuate ligament syndrome—a systematic review. J Robot Surg. 2024;18(1):318.
- Erden A, Yurdakul M, Cumhur T. Marked increase in flow velocities during deep expiration: A duplex Doppler sign of celiac artery compression syndrome. Cardiovasc Intervent Radiol. 1999;22(4):331–2.
- Park CM, Chung JW, Kim HB, Shin SJ, Park JH. Celiac Axis Stenosis: Incidence and Etiologies in Asymptomatic Individuals. Korean J Radiol. 2001;2(1):8–13.
- Shin TH, Rosinski B, Strong A, Fayazzadeh H, Fathalizadeh A, Rodriguez J, et al. Robotic versus laparoscopic median arcuate ligament (MAL) release: a retrospective comparative study. Surg Endosc. 2022;36(7):5416–23.
- Jaik NP, Stawicki SP, Weger NS, Lukaszczyk JJ. Celiac Artery Compression Syndrome: Successful Utilization of Robotic-Assisted Laparoscopic Approach. Journal of Gastrointestinal and Liver Diseases. 2007;16(1):93–6.
- Skelly CL, Mak GZ. Median arcuate ligament syndrome – Current state of management. Semin Pediatr Surg. 2021;30(6):151129.
- Hasler WL. Gastroparesis: Pathogenesis, diagnosis and management. Nat Rev Gastroenterol Hepatol. 2011;8(8):438–53.
- DERRICK JR, POLLARD HS, MOORE RM. The pattern of arteriosclerotic narrowing of the celiac and superior mesenteric arteries. Ann Surg. 1959;149(5):684–9.
- Ho KKF, Walker P, Smithers BM, Foster W, Nathanson L, O’Rourke N, et al. Outcome predictors in median arcuate ligament syndrome. J Vasc Surg. 2017;65(6):1745–52.
- Goodall R, Langridge B, Onida S, Ellis M, Lane T, Davies AH. Median arcuate ligament syndrome. J Vasc Surg. 2020;71(6):2170–6.
- Gloviczki P, Duncan AA. Treatment of celiac artery compression syndrome: Does it really exist. Perspect Vasc Surg Endovasc Ther. 2007;19(3):259–63.
- Jimenez JC, Harlander-Locke M, Dutson EP. Open and laparoscopic treatment of median arcuate ligament syndrome. J Vasc Surg. 2012;56(3):869–73.
- Chan SM, Weininger G, Kozhimala M, Sumpio BJ, Levine LJ, Harris S, et al. Utility of Hook Sign in the Diagnosis of Median Arcuate Ligament Syndrome. Ann Vasc Surg. 2023;94:165–71.
- Skelly CL, Stiles-Shields C, Mak GZ, Speaker CR, Lorenz J, Anitescu M, et al. The impact of psychiatric comorbidities on patient-reported surgical outcomes in adults treated for the median arcuate ligament syndrome. J Vasc Surg. 2018;68(5):1414–21.
- Stiles-Shields C, Osos S, Heilbrun A, Feldman ECH, Mak GZ, Skelly CL, et al. Targeting Coping to Improve Surgical Outcomes in Pediatric Patients With Median Arcuate Ligament Syndrome: Feasibility Study. Front Psychol. 2021;12:695435.
- Moak JP, Ramwell C, Fabian R, Hanumanthaiah S, Darbari A, Kane TD. Median Arcuate Ligament Syndrome with Orthostatic Intolerance: Intermediate-Term Outcomes following Surgical Intervention. Journal of Pediatrics. 2021;231:141–7.
- San Norberto EM, Romero A, Fidalgo-Domingos LA, García-Saiz I, Taylor J, Vaquero C. Laparoscopic treatment of median arcuate ligament syndrome: A systematic review. International Angiology. 2019;38(6):474–83.
- Björck M, Koelemay M, Acosta S, Bastos Goncalves F, Kölbel T, Kolkman JJ, et al. Editor’s Choice – Management of the Diseases of Mesenteric Arteries and Veins: Clinical Practice Guidelines of the European Society of Vascular Surgery (ESVS). European Journal of Vascular and Endovascular Surgery. 2017;53(4):460–510.
- Acampora C, Di Serafino M, Iacobellis F, Trovato P, Barbuto L, Sangiuliano N, et al. Insight into Dunbar syndrome: color-Doppler ultrasound findings and literature review. J Ultrasound. 2021;24(3):317–21.
- Petnys A, Puech-Leão P, Zerati AE, Ritti-Dias RM, Nahas WC, Neto ED, et al. Prevalence of signs of celiac axis compression by the median arcuate ligament on computed tomography angiography in asymptomatic patients. J Vasc Surg. 2018;68(6):1782–7.
- Aschenbach R, Basche S, Vogl TJ. Compression of the celiac trunk caused by median arcuate ligament in children and adolescent subjects: Evaluation with contrast-enhanced MR angiography and comparison with Doppler US evaluation. Journal of Vascular and Interventional Radiology. 2011;22(4):556–61.
- Patel M V., Dalag L, Weiner A, Skelly C, Lorenz J. Inability of conventional imaging findings to predict response to laparoscopic release of the median arcuate ligament in patients with celiac artery compression. J Vasc Surg. 2019;69(2):462–9.
- Scholbach T. Celiac artery compression syndrome in children, adolescents, and young adults: Clinical and color duplex sonographic features in a series of 59 cases. Journal of Ultrasound in Medicine. 2006;25(3):299–305.
- Horton KM, Talamini MA, Fishman EK. Median arcuate ligament syndrome: Evaluation with CT angiography. Radiographics. 2005;25(5):1177–82.
- Narwani P, Khanna N, Rajendran I, Kaawan H, Al-Sam R. Median arcuate ligament syndrome diagnosis on Computed Tomography: what a radiologist needs to know. Radiol Case Rep. 2021;16(11):3614–7.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 26/02/2025
Fecha de revisión: 03/03/2025
Fecha de aceptación: 23/04/2025
Cita el artículo: Morán Cerro A, Vaz Cardoso J. Implicaciones y relevancia clínica del ligamento arcuato medio en el dolor crónico abdominal. AMU. 2025;7(1):45-51.
URI: https://hdl.handle.net/10481/105372
