Martos Salcedo, Cynthia Raquel ¹; Marín Jiménez, Ángeles ¹; Córdoba Peláez, Paula ²;
Garrido Ruiz, Mª del Pilar ¹
1 Facultad de Medicina, Universidad de Granada
2 Facultad de Medicina, Universidad de Málaga
* Autor de correspondencia: angelesmarin03@correo.ugr.es
Resumen
Los ácidos grasos poliinsaturados de cadena larga (ÁGPICL) son claves en el neurodesarrollo embrionario, fetal y durante la infancia. Además, son esenciales para el ser humano, lo que significa que no se pueden sintetizar y han de ser ingeridos en la dieta. Durante el embarazo, se adquieren de forma directa a partir de los alimentos consumidos por la madre y en la infancia a través de la leche materna y de complementos nutricionales. Las conclusiones obtenidas sugieren que la toma de estos suplementos sería solamente útil para el neurodesarrollo del bebé en aquellas mujeres que tengan un déficit debido a factores exógenos como la dieta, o endógenos como factores genéticos para la polimerización ÁGPICL; así como en prematuros, no viéndose efectos aparentes en mujeres que poseen niveles normales de ÁGPICL ni en bebés nacidos a término.
Palabras clave: ácidos grasos poliinsaturados de cadena larga, neurodesarrollo, suplementación materna, embarazo.
Keywords: Long-chain polyunsaturated fatty acids, neurodevelopment, maternal supplementation, pregnancy.
1. Introducción
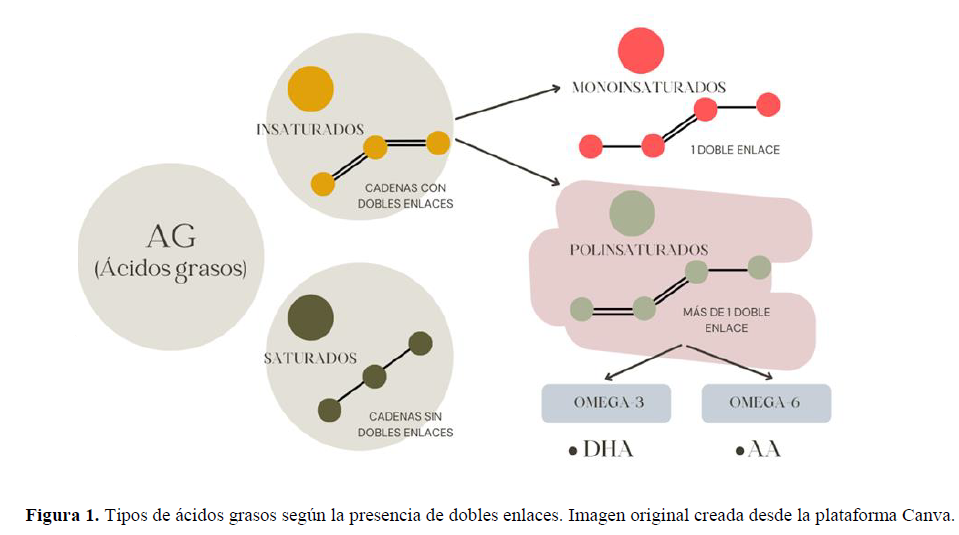
El consumo de ácidos grasos (ÁG) esenciales durante el embarazo y la lactancia es fundamental para el neurodesarrollo y el crecimiento normal del recién nacido (1). Los ÁG se clasifican en función de la presencia o ausencia de dobles enlaces en su estructura: si los presentan, hablamos de ÁG insaturados; si no es así, son ÁG saturados (Figura 1). Se les llama esenciales a aquellos ÁG que no pueden ser sintetizados por el organismo, entre estos se incluyen los ÁG omega-3 y omega-6. El DHA proviene concretamente del Ácido Alfa Linoleico (ALA), el cual es un tipo de omega-3 y el AA proviene del Ácido Linoleico (LA) el cual es un tipo de omega-6.
Ambas rutas, aunque parten de distintos ácidos omega comparten la enzima Delta-6-desaturasa, que se encargará de polimerizar y despolimerizar los ÁG hasta llegar a los productos.
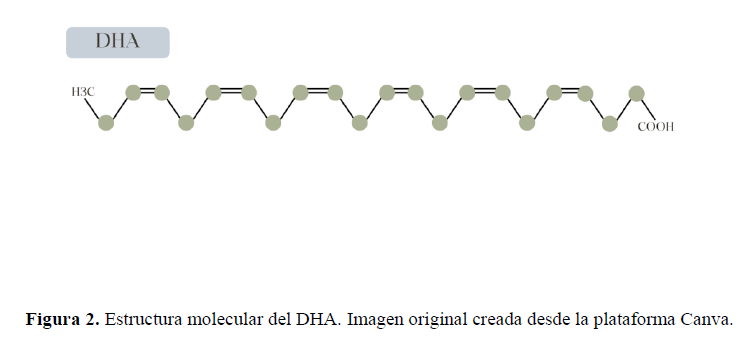
En la ruta del ALA, gracias a la enzima Delta-6-desaturasa pasaremos a ácido eicosatetraenoico (ETA), el cual pasará a un compuesto común en las dos rutas, el Delta-5-desaturasa y finalmente nos dará DHA o EPA. En resumen, la ruta comienza con un ÁG de 18 carbonos con 3 dobles enlaces en carbonos con 6 dobles enlaces en los carbonos 4,7,10,13,16 y 19 (DHA) (Figura 2).
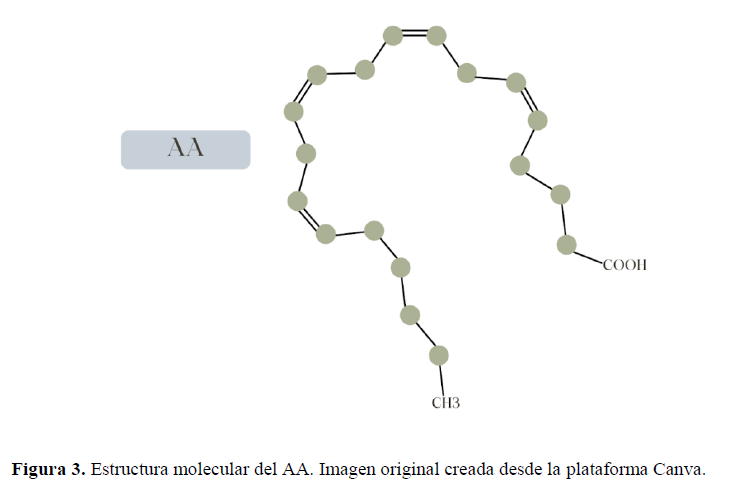
La ruta del AA tiene un paso más. Tras el paso de LA a ácido gamma-linoleico (GLA), pasaremos a ácido dihomo gamma- linoleico (DGLA), llegando al Delta-5-desaturasa y finalmente al AA. Esta ruta comienza con un ÁG de 18 átomos de carbono y 2 dobles enlaces en los carbonos 9 y 12 (LA) y finaliza con un ÁG de 20 carbonos con 4 dobles enlaces en los carbonos 5,8,11 y 14 (AA) (Figura 3). La regulación de ambas rutas será externa (por reguladores) e interna (entre ambas rutas) (2).
La regulación externa por enzimas viene codificada por una serie de genes denominados FADS encontrados en el cromosoma 11 (3,4). Se reconocen varios alelos de los genes FADS (mutaciones que comparten más del 1% de la población) denominados SNPs (polimorfismos de nucleótido único por sus siglas en inglés). Cada SNP está mutado de manera distinta, por lo que de ser una mutación lo suficientemente relevante, podrían observarse en la leche materna diferentes concentraciones de los ÁG derivados de los esenciales, ya sea un aumento o una disminución.
Dentro de los omega-3, destacan el ácido eicosapentaenoico (EPA) y DHA y dentro de los omega-6, el AA. Entre todos, el DHA es el ÁGPICL el más estudiado.
El objetivo de esta revisión es analizar el efecto que tiene la suplementación materna con este tipo de ácidos grasos en el desarrollo del organismo, con el objetivo de recopilar la información disponible sobre si la toma de los mismos durante el embarazo puede tener repercusión sobre el desarrollo del niño. Finalmente, se ha realizado una discusión y se han planteado perspectivas futuras sobre la evidencia de esta suplementación.
1.1. Participación fisiológica de los ÁGPICL en el neurodesarrollo
Muchos de los ÁGPICL forman parte de las membranas celulares, mayoritariamente de la acetilcolina, fosfatidiletanolamina y la fosfatidilserina, por tanto, tienen una función estructural. Además, debido a sus dobles enlaces dan fluidez a la misma, lo que es determinante en la formación de estructuras nerviosas como el cerebro y también para el desarrollo de conos y bastones del tejido ocular (5). Los ÁGPICL omega-3 son esenciales para la comunicación celular y la transducción de señales intracelulares, como moduladores de la respuesta inflamatoria, e incluso tienen efectos antinflamatorios directos, mediados por eicosanoides (6).
El EPA es básico para la regulación de la funcionalidad cerebral (señal celular y riego sanguíneo neuronal), el desarrollo óptimo del cerebro y la vista, y la síntesis de prostaglandinas (7,8,9).
El DHA posee función estructural ya que forma parte de las membranas celulares al ser un componente de la fosfatidilcolina, fosfatidiletanolamina y esfingolípidos. El DHA también tiene función de reconocimiento al ser parte de los gangliósidos, que además facilitan la unión de neurotransmisores a la membrana sináptica (4). Otra de sus implicaciones es la neurogénesis, con el almacenamiento de la información y memoria.
El AA puede ser liberado de los fosfolípidos de membrana en cualquier momento por enzimas lipoxigenasas y ciclooxigenasas para actuar con propiedades antiinflamatorias: pueden bloquear agentes proinflamatorios o bien generar antinflamatorios. Junto con el DHA representa una quinta parte del contenido de ÁG del cerebro.
El correcto funcionamiento fisiológico de cada ÁG depende de la correcta concentración del mismo, lo que a su vez está directamente relacionado con la cantidad de enzimas de la ruta metabólica, codificados en los genes FADS ya mencionados en la introducción (3,4). En función de qué SNP posea la madre, se encuentra o no variación de unos u otros ÁGPICL tanto en la sangre como en la leche materna.
2. Suplementación en el embarazo
Los ÁGPICL mayormente estudiados son los omega-3 y los omega-6, los cuales fueron medidas sus concentraciones en leche materna y en sangre materna (3,4) para observar una correlación con distintos SNPs. Respecto al estudio (3), no se observó una relación notable respecto la cantidad de ácidos grasos omega-3 y la concentración de ÁG.
Algunos estudios han encontrado una leve significación en la mejora del neurodesarrollo en niños cuyas madres tomaron suplementos sin tener un déficit de ÁGPICL en su dieta (7,9,10,11,12). Estos mostraban ciertas ventajas relacionadas con un mejor desarrollo cognitivo a los 18 meses de edad (atención mantenida, memoria a corto plazo, inhibición de conducta…) (10), y una mejor coordinación en niños de 24 (7,9,11) y 30 meses (12). También hubo indicios de la mejoría de la vista (9) pero el p-valor de la diferencia estudiada entre los niños suplementados y los no suplementados no llegó a ser significativo.
A su vez estos cinco estudios (7,9,10,11,12) concluyeron que, una vez llegada la edad escolar, la diferencia entre los suplementados y no tampoco fue significativa. Para comprobar si ese efecto que se encuentra en la temprana infancia acaba marcando el neurodesarrollo de durante la etapa escolar, o incluso en la adultez, uno de ellos en particular (7) insiste en la necesidad de realizar más estudios en los que se lleve a cabo un seguimiento de los niños en edades más avanzadas. Por ejemplo, un estudio (13) encontró que los niños nacidos de madres con una mayor ingesta de mariscos durante el embarazo mejoraron las habilidades motoras finas, un comportamiento prosocial más significativo, una inteligencia verbal más alta y puntajes más altos de desarrollo social a los ocho años de edad.
Por otro lado, dos de los estudios (8,14) comprobaron cómo los niños que recibieron el suplemento de ácidos omega-3 durante el embarazo (preparado tomado vía oral) tendían a alargar el embarazo, en promedio, dos días y medio, con lo cual nacían con mayor peso y tamaño. Debido a que uno de ellos (14) tiene una muestra más variada, es apreciable la sugerencia de que tal vez los ÁGPICL ayuden a evitar un parto prematuro; aunque no existe una evidencia firme sobre ello.
Cabe destacar que un experimento realizado en ratas (15) encontró ciertos efectos negativos en el SNC de las madres que habían recibido el suplemento, presentando una peor mielinización como consecuencia de la respuesta auditiva del tronco encefálico, que es sensible para identificar los efectos de la dieta en el neurodesarrollo. Sin embargo, no se ha encontrado información en relación a ello en humanos.
2.1. DHA
El DHA es el primer ÁGPICL más estudiado. Por ello se midió su concentración en leche materna y en sangre materna (3,4) para observar una correlación con distintos SNPs.
Si bien en el estudio (3) no se observó ninguna relevancia a los ÁG omega-3 y por tanto de los DHA, en un estudio de Moltó-Puigmartí presenció una pronunciada diferencia entre la concentración de las mujeres con un determinado genotipo y el consumo semanal de grasa de pescado. Esto pudo condicionar los resultados, ya que el estudio se realizó sobre una población alemana, donde el consumo de pescado es menor.
Un artículo respecto a la suplementación materna de DHA (16) recopilaba varios estudios en los cuales se suplementaban oralmente con un preparado a las madres con y sin un déficit en la dieta de DHA. Todos estos estudios varían tanto la cantidad de dosis, como el periodo de suplementación, la edad máxima de seguimiento de los niños, así como las pruebas y escalas de medida, lo que impide la comparación de resultados entre sí.
En el primero de los casos, la suplementación en mujeres sin déficit de DHA comenzó entre las semanas 18-20 del embarazo. Dicha suplementación tenía unas dosis diarias de 0,8-2,2 g, las cuales terminaron tras tres meses de dar a luz. Se observaron tres etapas distintas de resultados: la primera a los 2,5 años, donde los niños mostraron mejoras motoras en la coordinación; una segunda a los 4 años y una tercera a los 7, en las que se encontraron mejoras cognitivas.
En el segundo caso la suplementación también se dio en mujeres sin déficit de DHA e inició en la semana 24 del embarazo hasta el parto. Dicha suplementación constaba de una dosis de 300mg/día. Al igual que en el caso anterior se dividían los periodos en 3 etapas, las cuales estaban recogidas dentro del primer año de vida: la primera a los 4 meses, donde se apreciaban diferencias en la agudeza visual; la segunda a los 6 meses, donde esas agudezas desaparecen; y una tercera a los 9 meses donde se observaba mejoría en la resolución de problemas.
En el tercer caso la suplementación tuvo lugar en mujeres con un déficit de DHA en la dieta. Para relacionar esta condición con el neurodesarrollo se tomaron dos muestras, en las cuales unas mujeres fueron suplementadas a partir de la semana 18 de gestación hasta el final de este con una dosis de hasta 400 mg/día. Los niños cuyas madres recibieron una dosis que osciló entre los 200-400 mg/día mostraron un menor riesgo de baja agudeza visual respecto aquellos cuyas madres no fueron suplementadas. Aquellas mujeres cuya dosis resultó menor a 200 mg/día no demostraron que sus hijos tuvieran datos significativos respecto a aquellas que no se suplementaron.
Asimismo, continuando con el estudio del déficit de DHA en la dieta materna, se realizó un cuarto estudio donde las madres fueron suplementadas durante los 4 primeros meses de lactancia. En este caso se utilizó una dosis oral de 200 mg/día y los niños mostraron mejoras psicomotoras hasta una edad de 30 meses. Dichas agudezas fueron medidas según el ranking del Índice de Desarrollo Psicomotor de Bayley (PDI).
2.2. DHA y AA
El AA es el segundo ÁGPICL más estudiado después del DHA. Por ello se midió su concentración en leche y sangre materna (3,4) para observar una correlación con distintos SNPs.
Se observó una disminución en la concentración de AA en aquellas mujeres que portaban un SNP menos común respecto de aquellas cuyo alelo era más común. Los SNPs observados en un primer momento (rs174547 y rs174556) se mostraron a los 6 meses después de nacer. Sin embargo, tras una corrección de test múltiple, al mes y medio se presenció una gran asociación entre los SNPs rs174626, rs1000778 y rs174455.
Por el contrario, hubo ciertos SNPs que al estar presentes en el genoma materno no mostraron una variación en la concentración de AA. Estos fueron el rs174602, rs498793 y el rs526126.
Dos estudios comprendidos en el mismo artículo (17) evaluaron el efecto en el neurodesarrollo de distintas ratios de suplementación (tomados vía oral) de preparados de AA y DHA sin incluir otros tipos de ÁCPICL. Un grupo tenía una ratio de AA:DHA de 1:1 y el otro de 2:1. La suplementación comenzó como máximo con 33 semanas de gestación y se dio a través de aceite de pescado o de soja a las madres. El grupo de madres que continuó con la suplementación durante un año tras el parto bien siguió tomando el aceite si dieron el pecho o bien alimentó a sus hijos con fórmulas enriquecidas en AA y DHA. Los resultados no fueron significativamente distintos de los niños alimentados solamente durante el embarazo y los que continuaron tras este en el grupo con la ratio 2:1.
A los 18 meses no se encontró ninguna diferencia entre los grupos, pero hubo una mayor mejora psicomotriz a los 24 meses en el estudio con la ratio 2:1 que en el 1:1, por lo que se sospecha que afectó la menor cantidad de AA. No obstante, no se encontraron diferencias en el comportamiento o en la atención entre las edades 3-5 años, ni en el IQ a los 7 años. El estudio del AA ha demostrado que de forma individual no aporta una gran diferencia respecto a la suplementación de DHA. Este bajo impacto propone el estudio combinado de ambos suplementos (18). Sin embargo, no hay estudios suficientes para afirmar que la combinación de ambos, o la suplementación de uno solo implique una diferencia significativa respecto aquellos niños sin suplementación (19).
3. Efecto de la suplementación en recién nacidos prematuros
La mejora en el neurodesarrollo gracias a la suplementación es mucho más evidente en los niños prematuros que en los nacidos a término (14,17,20,21,22).
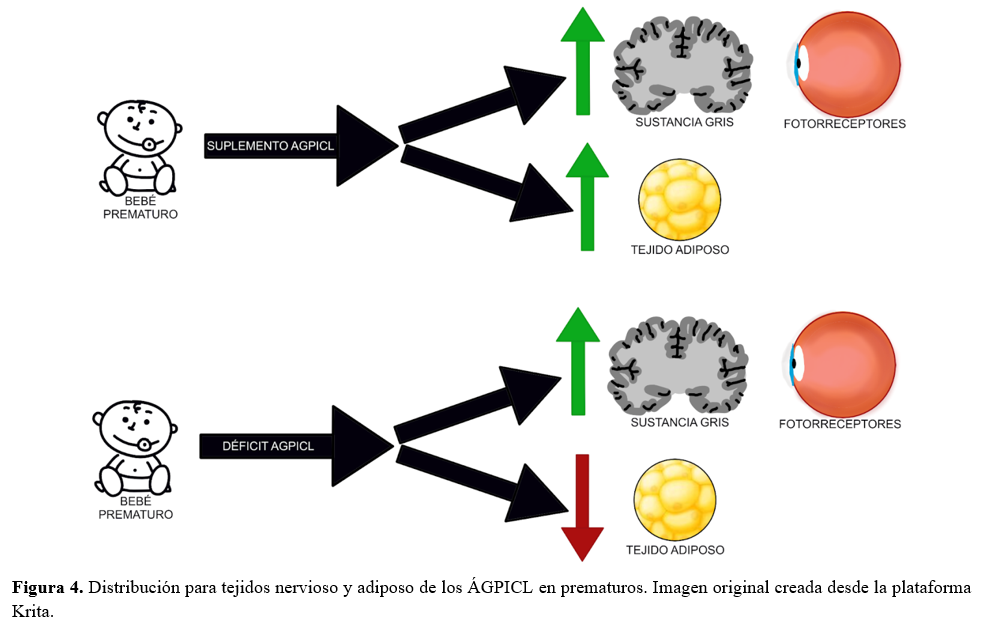
Entre la literatura encontrada se prioriza la investigación de la relación entre la deficiencia de ÁGPICL y los posibles efectos negativos sobre el neurodesarrollo. Destaca un estudio (20) realizado en niños nacidos a término que expuso la conexión entre los tejidos nervioso y adiposo donde se llegó a la conclusión de que ante un déficit de ÁGPICL en el tejido adiposo se aprecia una atrofia, debido al desplazamiento de dichas biomoléculas hacia el tejido nervioso. Esto se hace más evidente en los prematuros porque su SN, especialmente la sustancia gris y los fotorreceptores, no está desarrollado completamente (14,18). Por estos motivos la suplementación de ÁGPICL en prematuros se vuelve esencial (Figura 4).
Por todo lo descrito hasta ahora, se destaca la obligatoriedad por ley de incluir ácidos omega-3 y 6 en las fórmulas de leche para bebés (22), ya que no han encontrado efectos negativos de la suplementación. De hecho, se recomienda cuando hay un déficit de ÁGPICL ya que sí hay evidencia de que resulta beneficioso en el neurodesarrollo.
4. Limitaciones
En primer lugar, las muestras en la mayoría de estudios no eran lo suficientemente diversas. Las madres sí tenían edades diferentes en general pero el estudio de las poblaciones fue limitado, ya que casi todos los estudios se centraban en Europa central. Las condiciones socioeconómicas (14), climáticas e incluso culturales de la población influenciaron los resultados, sobre todo desde el punto de vista dietético, ya que no es la misma alimentación la recibida entre los distintos países europeos. Tampoco era igual la condición económica de cada familia para obtener alimentos más ricos en grasas de pescado, como supondría de la dieta mediterránea en contraste con las mujeres que participaron y que tenían una baja ingesta de ÁGPICL (24).
Las circunstancias de cada estudio y a sí mismo de cada individuo pueden suponer una limitación en la concentración de ÁGPICL transmitidos al niño para su neurodesarrollo. Por lo que, a la hora de estudiar la suplementación, aquellos estudios donde los niveles de concentración base rondaban los valores normales o elevados dieron unos resultados apenas apreciables, mientras que aquellos cuyas concentraciones eran bajas obtuvieron resultados más que favorables. Es por ello que muchos de los estudios concluían con la necesidad de obtener más muestras diversas, ya sea de diferentes nacionalidades, culturas o dietas como posible solución.
5. Conclusiones
La evidencia parece indicar que la suplementación es innecesaria cuando los requerimientos nutricionales están cubiertos por la dieta y la genética. Sin embargo, en aquellas embarazadas que tengan un déficit en alguno de estos ÁG, puede ser de utilidad la toma de suplementos con la finalidad de mejorar el neurodesarrollo del bebé.
Asimismo, la suplementación de los niños prematuros ha concluido grandes resultados positivos, siendo apoyada esta información con la regulación por ley de la concentración de ÁG en las leches en polvo para prevenir y cubrir todos los posibles requerimientos metabólicos (22).
A pesar de ello, aunque parece ser innecesaria la suplementación en neonatos sanos nacidos a término, aún no se dispone de la suficiente evidencia como para afirmar dicha conclusión que realmente pueda ser beneficiosa (16). Por todo ello, se ha concluido que se necesitan más estudios para dar una respuesta certera a la cuestión que se plantea en esta revisión, y poder conocer más a fondo la utilidad de estos ÁGPICL.
Declaraciones
Agradecimientos
Las autoras de este trabajo agradecen la implicación de los coordinadores y docentes del curso «Producción y traducción de artículos biomédicos (IV ed.)».
Conflictos de interés
Los autores declaran no tener ningún conflicto de interés.
Financiación
Ninguna.
Referencias
1. Montes Martín Islán ÁP. Ácidos grasos esenciales. Omega-3 y Omega-6. Offarm. 2010.
2. Velarde Omega-3 y Omega-6: el obligado equilibrio. neuronae 2014. https://www.neuronae.net/post/2014/11/06/omega3-y-omega6-el-obligado-equilibrio.
3. Lattka E, Rzehak P, Szabó É, Jakobik V, Weck M, Weyermann M, et Genetic variants in the FADS gene cluster are associated with arachidonic acid concentrations of human breast milk at 1.5 and 6 mo postpartum and influence the course of milk dodecanoic, tetracosenoic, and trans-9-octadecenoic acid concentrations over the duration of lactation. Am J Clin Nutr 2011;93:382–91.
4. Xie L, Innis Genetic variants of the FADS1 FADS2 gene cluster are associated with altered (n-6) and (n-3) essential fatty acids in plasma and erythrocyte phospholipids in women during pregnancy and in breast milk during lactation. J Nutr 2008;138:2222–8.
5. Morales BR, González IG, Morales AM, Sanhueza PJ, Valenzuela Ácidos grasos poliinsaturados de cadena larga ω-3 y enfermedad cardiovascular. Revista Chilena de Nutrición n.d.
6. Fetterman JW Jr, Zdanowicz MM. Therapeutic potential of n-3 polyunsaturated fatty acids in Am J Health Syst Pharm 2009;66:1169–79.
7. Azaryah H, Verdejo-Román J, Martin-Pérez C, García- Santos JA, Martínez-Zaldívar C, Torres-Espínola FJ, et Effects of maternal fish oil and/or 5-methyl- tetrahydrofolate supplementation during pregnancy on offspring brain resting-state at 10 years old: A follow- up study from the NUHEAL randomized controlled trial. Nutrients 2020;12:2701.
8. Heath RJ, Klevebro S, Wood Maternal and neonatal polyunsaturated fatty acid intake and risk of neurodevelopmental impairment in premature infants. Int J Mol Sci 2022;23:700.
9. Meldrum S, Dunstan JA, Foster JK, Simmer K, Prescott Maternal fish oil supplementation in pregnancy: a 12 year follow-up of a randomised controlled trial. Nutrients 2015;7:2061–7.
10. Nevins JEH, Donovan SM, Snetselaar L, Dewey KG, Novotny R, Stang J, et al. Omega-3 fatty acid dietary supplements consumed during pregnancy and lactation and child neurodevelopment: A systematic review. J Nutr 2021;151:3483–94.
11. Dziechciarz P, Horvath A, Szajewska H. Effects of n-3 long-chain polyunsaturated fatty acid supplementation during pregnancy and/or lactation on neurodevelopment and visual function in children: a systematic review of randomized controlled J Am Coll Nutr 2010;29:443–54.
12. Chmielewska A, Dziechciarz P, Gieruszczak-Białek D, Horvath A, Pieścik-Lech M, Ruszczyński M, et Effects of prenatal and/or postnatal supplementation with iron, PUFA or folic acid on neurodevelopment: update. Br J Nutr 2019;122:S10–5.
13. Lauritzen L, Carlson Maternal fatty acid status during pregnancy and lactation and relation to newborn and infant status: Transfer of fatty acids from mother to child. Matern Child Nutr 2011;7 Suppl 2:41–58.
14. Makrides M, Collins CT, Gibson RA. Impact of fatty acid status on growth and neurobehavioural development in humans: Fatty acids, growth and Matern Child Nutr 2011;7 Suppl 2:80–8.
15. Haubner LY, Stockard JE, Saste MD, Benford VJ, Phelps CP, Chen LT, et Maternal dietary docosahexanoic acid content affects the rat pup auditory system. Brain Res Bull 2002;58:1–5.
16. Lauritzen L, Fewtrell M, Agostoni Dietary arachidonic acid in perinatal nutrition: a commentary. Pediatr Res
17. Delgado-Noguera MF, Calvache JA, Bonfill Cosp X. Supplementation with long chain polyunsaturated fatty acids (LCPUFA) to breastfeeding mothers for improving child growth and Cochrane Database Syst Rev 2010:CD007901. 2015;77:263–9.
18. Klevebro S, Juul SE, Wood A more comprehensive approach to the neuroprotective potential of long-chain polyunsaturated fatty acids in preterm infants is needed- should we consider maternal diet and the n-6:N-3 fatty acid ratio? Front Pediatr 2019;7:533.
19. Sass L, Bjarnadóttir E, Stokholm J, Chawes B, Vinding RK, Mora-Jensen A-RC, et al. Fish oil supplementation in pregnancy and neurodevelopment in childhood-A randomized clinical Child Dev 2021;92:1624–35.
20. De Giuseppe R, Roggi C, Cena n-3 LC-PUFA supplementation: effects on infant and maternal outcomes. Eur J Nutr 2014;53:1147–54.
21. Gould JF, Colombo J, Collins CT, Makrides M, Hewawasam E, Smithers LG. Assessing whether early attention of very preterm infants can be improved by an omega-3 long-chain polyunsaturated fatty acid intervention: a follow-up of a randomised controlled BMJ Open 2018;8:e020043.
22. BOE.es – DOUE-L-2016-80201 Reglamento Delegado (UE) 2016/127 de la Comisión, de 25 de septiembre de 2015, que complementa el Reglamento (UE) no 609/2013 del Parlamento Europeo y del Consejo en lo que respecta a los requisitos específicos de composición e información aplicables a los preparados para lactantes y preparados de continuación, así como a los requisitos de información sobre los alimentos destinados a los lactantes y niños de corta edad. Boe.es n.d. https://www.boe.es/buscar/doc.php?id=DOUE-L-2016-80201.
23. Agostoni C. Docosahexaenoic acid (DHA): from the maternal-foetal dyad to the complementary feeding Early Hum Dev 2010;86 Suppl 1:3–6.
24. Valentine CJ, Morrow G, Pennell M, Morrow AL, Hodge A, Haban-Bartz A, et al. Randomized controlled trial of docosahexaenoic acid supplementation in midwestern U.S. human milk donors. Breastfeed Med 2013;8:86–91.
AMU 2022. Volumen 4, Número 1
Fecha de envío: Fecha de aceptación: Fecha de publicación:
23/03/2022 04/04/2022 31/05/2022
Cita el artículo: Martos Salcedo, Cynthia Raquel; Marín Jiménez, Ángeles; Córdoba Peláez, Paula; Garrido Ruiz, Mª del Pilar. Efecto de la suplementación de ácidos grasos poliinsaturados de cadena larga durante el embarazo en el neurodesarrollo infantil. AMU. 2022; 4(1): 57-64
