Carrasco Cáliz, Ana ¹; González Alcaide, Manuel ²*; Ruiz del Pino, Marta ¹
1 Unidad de Cuidados Intensivos, Hospital Virgen de las Nieves.
2 Estudiante de grado de medicina de la universidad de Granada.
* Autor de correspondencia: mangonalc@gmail.com
Todos los autores han contribuido en la realización de este trabajo por igual.
Resumen
Introducción/Objetivos
Analizar si durante la pandemia de COVID-19 se ha producido un aumento en el número de Angiografías Pulmonares por Tomografía Computarizada (APTC) solicitadas. Estudiar los cambios acontecidos en la incidencia de tromboembolismo pulmonar (TEP). Analizar variables radiológicas de sobrecarga de cavidades cardíacas derechas e hipertensión pulmonar.
Material y Métodos
Estudio observacional retrospectivo longitudinal basado en una serie consecutiva de casos del Hospital Universitario Virgen de las Nieves de Granada (España) sobre dos cohortes: pacientes a los que se les solicitó una APTC por sospecha de TEP durante el primer año de la pandemia por COVID-19 (cohorte pandémica) comparado con pacientes a los que se les solicitó una APTC por el mismo motivo y durante el mismo intervalo de tiempo del año previo (cohorte prepandémica). Las variables empleadas para medir la sobrecarga de cavidades derechas fueron: calibre de Arteria Pulmonar, Ratio Ventrículo Derecho/Ventrículo Izquierdo, Ratio Arteria Pulmonar/Aorta, Modificación del tabique interventricular, Reflujo a Vena Cava Inferior o suprahepáticas.
Resultados
Se solicitaron en total 1375 APTC durante el período pandémico, frente a 530 durante el período prepandémico. No se detectaron diferencias en la incidencia de TEP entre ambas cohortes (23,2% prepandémica versus 19,6% pandémica). Sin embargo, sí aumentó la incidencia de TEP periféricos durante la pandemia (6,5% versus 42%). Estos TEP periféricos se acompañaron de menor sobrecarga de cavidades cardíacas derechas e hipertensión pulmonar que los de localización central.
Conclusiones
Hemos detectado un notable aumento en el número de APTC realizadas durante el período de pandemia sin observarse un aumento significativo de la incidencia de TEP con respecto al período prepandemia (p=0,078). No obstante, se ha producido un aumento en la incidencia de TEP periféricos, acompañados de menor repercusión hemodinámica que los centrales.
Palabras clave: Tromboembolismo pulmonar, APTC, pandemia, COVID-19.
Keywords: pulmonary thromboembolism, CTPA, pandemic, COVID-19
1. Introducción
El tromboembolismo pulmonar (TEP) constituye un problema de salud pública de gran magnitud, ya que, a pesar de ser menos frecuente que el infarto de miocardio o el ictus, su gravedad es equiparable a la de dichas enfermedades y supone una importante causa de mortalidad. Así, se estima una incidencia aproximada de TEP de un caso por cada 1000 habitantes al año, aunque probablemente esta se encuentre subestimada (1,2).
El mecanismo fisiopatológico subyacente consiste en el enclavamiento, en alguna de las arterias pulmonares, de un émbolo originado en el territorio venoso profundo, tratándose en la mayoría de los casos de una trombosis venosa profunda en miembros inferiores que, a menudo, es asintomática (3) (figura 1). Entre los factores de riesgo para desarrollar TEP destacan: la cirugía mayor reciente, especialmente ortopédica (prótesis de cadera o rodilla), las fracturas en miembros inferiores, los politraumatismos, el daño espinal, las situaciones que impliquen inmovilización, el puerperio, los antecedentes personales de enfermedad tromboembólica venosa, la terapia hormonal estrogénica, la trombofilia, el cáncer, la quimioterapia, el ser portador de catéteres venosos, etc. (1).
El diagnóstico de TEP se ha basado tradicionalmente en la combinación de la sospecha clínica, los niveles de dímero-D y la información aportada por las pruebas de imagen (4,5). Históricamente el diagnóstico de TEP ha supuesto un reto para los clínicos y, durante la pandemia, estas dificultades diagnósticas se han hecho aún más acuciantes, por varias razones que a continuación describimos (6):
- Solapamiento sintomatológico existente entre la propia infección por COVID-19 y muchas de sus posibles complicaciones (disnea de nueva aparición o empeoramiento de la disnea basal, dolor torácico, síncopes, hipotensión). Las escalas habitualmente empleadas para estimar la probabilidad pretest de TEP, como la escala Wells o la de Ginebra, no han sido aún validadas en el contexto de la infección por COVID-19 (7,8).
- Incertidumbre existente en torno a la adecuada interpretación y la verdadera significación del aumento, casi generalizado, de los niveles de dímero-D, que pone de manifiesto la necesidad de realizar más estudios para comprobar si los puntos de corte empleados previamente por su elevado valor predictivo negativo siguen siendo válidos en estos pacientes (6,9-11).
- Dificultad que entraña la realización de Angiografía Pulmonar por Tomografía Computarizada (APTC) u otras pruebas de diagnóstico por imagen en pacientes hospitalizados a menudo inestables y, en su mayoría, dependientes de ventilación mecánica, especialmente en el contexto de la pandemia (6). Esta dificultad para disponer de APTC ha contribuido a un mayor uso de la ecografía compresiva de miembros inferiores con el objetivo de identificar trombosis venosa profunda y justificar la indicación de anticoagulación ante la sospecha de TEP cuando no puede ser confirmada (12).
La controversia es aún mayor si nos centramos en los TEP de localización periférica. No existe un consenso amplio sobre la influencia que tiene esta patología en el pronóstico de los pacientes y, por tanto, aún no hay directrices claras a seguir en lo que se refiere al diagnóstico y tratamiento de esta entidad. (13-15).
Son muchos los autores que defienden que la COVID-19 está directamente implicada en el estado protrombótico que parecen presentar muchos de los pacientes infectados (16). Esta podría ser una de las razones por las que durante la pandemia parece haber aumentado la incidencia de TEP, también la de los periféricos (figura 2) (17,18). En este contexto de incertidumbre, adquiere una importancia capital la realización de estudios que nos permitan avanzar en el conocimiento, proporcionen evidencias en las que basar las decisiones clínicas y, por ende, mejoren la atención a los pacientes.
El objetivo principal de este trabajo es comprobar si existen diferencias en la incidencia de TEP, diagnosticado mediante APTC, entre los períodos prepandemia y pandemia COVID- 19, analizando si existen diferencias según la localización (TEP central y TEP periférico) y cómo afecta dicho factor a la estabilidad hemodinámica de los pacientes, empleando para valorarla parámetros radiológicos asociados a sobrecarga de cavidades derechas.
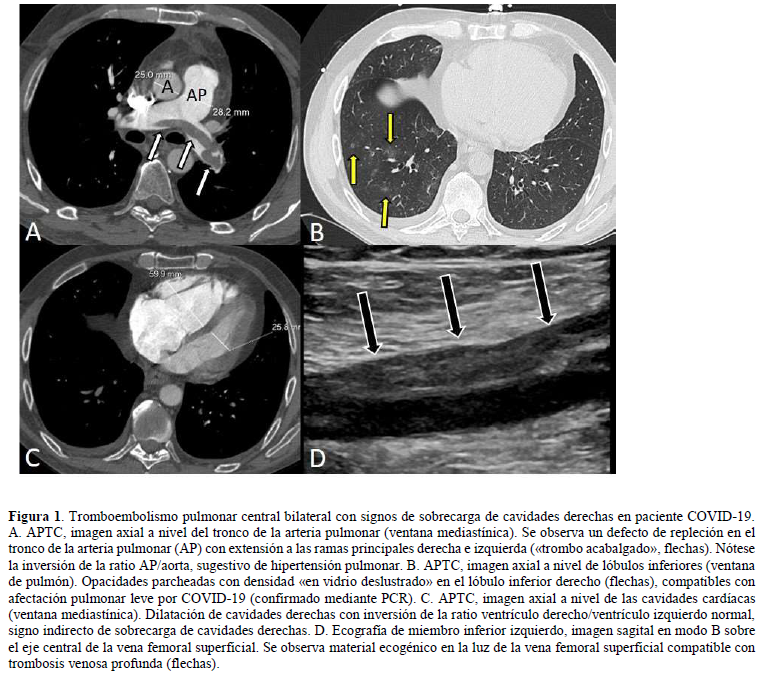
2. Material y Métodos
Se llevó a cabo un estudio observacional retrospectivo longitudinal basado en una serie consecutiva de casos atendidos en el Hospital Universitario Virgen de las Nieves de Granada (España). Se seleccionaron dos grupos de pacientes: en primer lugar, una cohorte integrada por pacientes a los que se les realizó una Angiografía Pulmonar por Tomografía Computarizada (APTC) de emergencia por sospecha de TEP durante el primer año de pandemia (cohorte pandémica: del 15 de marzo de 2020 al 14 de marzo de 2021); y, en segundo lugar, otra cohorte con los mismos criterios de inclusión, pero con pacientes seleccionados durante el año previo al comienzo de la pandemia (cohorte prepandémica: del 15 de marzo de 2019 al 14 de marzo de 2020). La cohorte pandémica fue seleccionada de forma independiente al estado de infección por SARS-CoV-2. Los criterios de exclusión empleados fueron: edad menor de 15 años, solicitud de la APTC fuera de urgencias, Tomografía Computarizada no diagnóstica por artefactos u otros problemas como la extravasación del contraste, sospecha diagnóstica distinta al TEP y TEP crónico.
Para seleccionar ambas cohortes se usó la base de datos del Sistema de Información Radiológica de dicho hospital, atendiendo a todas las APTC disponibles dentro del sistema de comunicación y archivado de imágenes médicas (SCAI). Como criterio de búsqueda se usaron los términos clave «embolia pulmonar» y «tromboembolismo pulmonar», seleccionando los informes radiológicos que los contuvieran. Una vez seleccionados, se revisaron manualmente dichos informes y se les aplicaron los criterios de exclusión mencionados con anterioridad.
Las variables estudiadas en cada paciente fueron:
- Edad y sexo
- Fecha de realización de la APTC.
- Localización del TEP atendiendo a si es central (arterias principales o lobares) o periférico (arterias segmentarias o subsegmentarias).
A su vez, dentro de la variable de TEP confirmada, se valoraron los siguientes signos radiológicos de sobrecarga de cavidades derechas o hipertensión pulmonar:
- Calibre de la arteria pulmonar (calibre AP).
- Ratio Ventrículo Derecho / Ventrículo izquierdo (ratio VD/VI).
- Ratio Arteria Pulmonar / Aorta (ratio AP/Ao).
- Modificación del tabique interventricular (IV).
- Reflujo a Vena Cava Inferior (VCI) o venas suprahepáticas.
Una vez seleccionada la muestra final, se realizó un estudio descriptivo de los distintos subgrupos y un análisis estadístico comparando las distintas variables recogidas, utilizando el test de chi-cuadrado en las variables cualitativas y test T de Student en las cuantitativas. Para ello se usó el programa estadístico IBM SPSS Statistics versión 25 (IBM Corp., Armonk, Nueva York, Estados Unidos).
3. Resultados
El estudio que presentamos incluyó a un total de 1905 pacientes con una media de edad de 68,3 años (desviación estándar=16,5), como muestra la tabla 1. El 20,6% del total de pacientes (n=392) presentaron TEP. El 69,1% de dichos TEP se produjeron en localización central y el 30,9% en localización periférica.
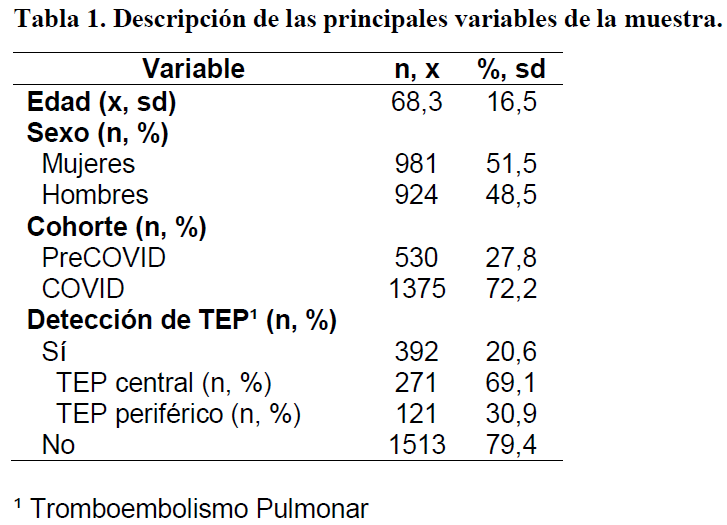
El total de pacientes se dividió en dos grupos (tabla 2): la cohorte prepandémica, integrada por 530 pacientes, con una incidencia de TEP de 23,2%, siendo el 93,5% de ellos centrales y el 6,5%, periféricos; y cohorte pandémica, con un total de 1375 pacientes. En este último grupo, la incidencia de TEP fue de 19,6%, por tanto, menor que en la cohorte prepandémica, aunque no se detectaron diferencias. El 58% de los TEP diagnosticados en la cohorte pandémica fueron centrales y el 42% periféricos. Existen diferencias significativas (p<0,05) entre ambos grupos en cuanto a la localización del TEP. Así, el diagnóstico de TEP periférico fue más frecuente durante el período pandémico.
Se detectaron diferencias en la variable edad entre ambos grupos de comparación (tabla 2). Los pacientes pertenecientes a la cohorte pandémica fueron ligeramente más jóvenes que los del grupo control (67,7 años de edad media en la cohorte pandémica versus 69,9 en la cohorte prepandémica).
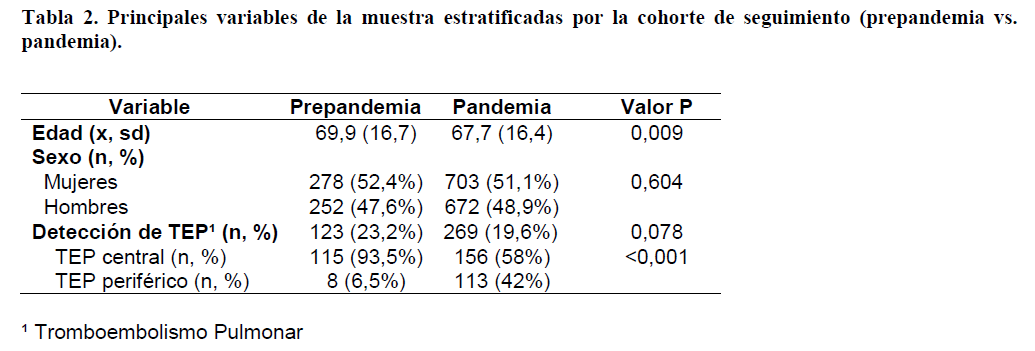
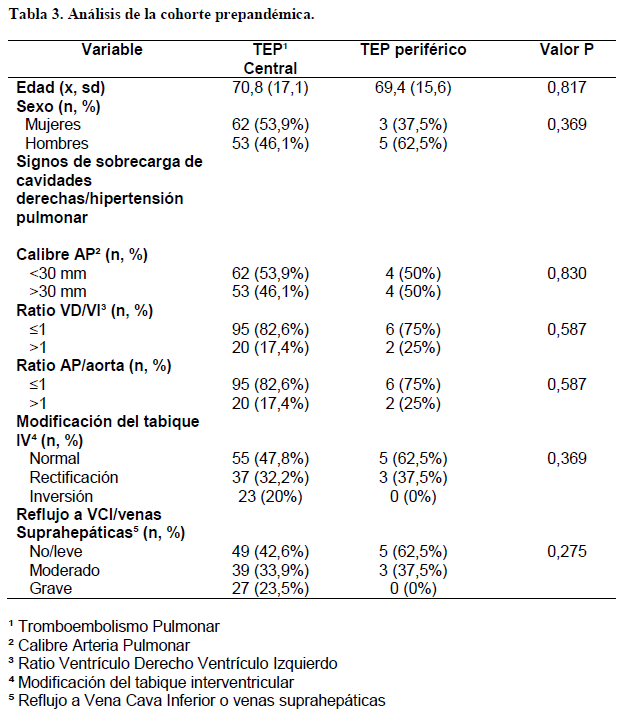
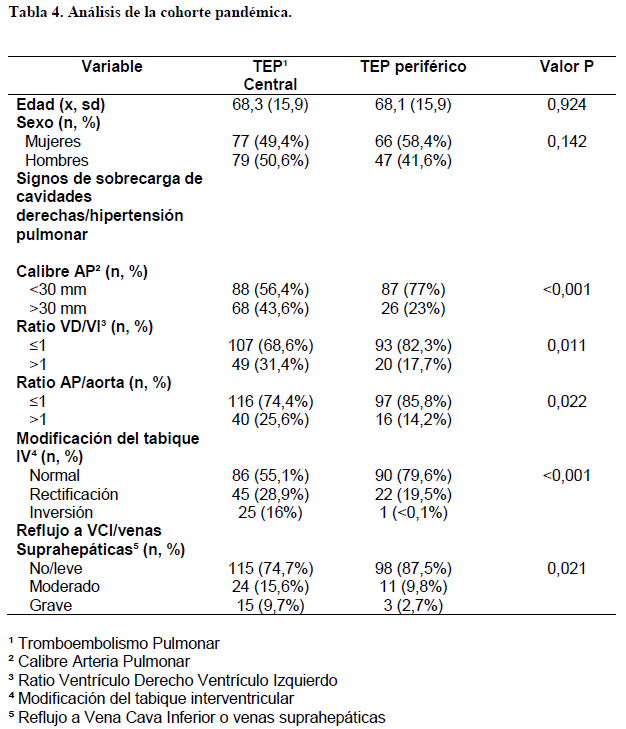
Si nos centramos en la cohorte prepandémica, dentro del análisis por subgrupos realizado en función de la localización del TEP (tabla 3), no se encontraron diferencias en ninguna de las variables estudiadas. Por el contrario, al evaluar la cohorte pandémica (tabla 4), se observó que todos los análisis comparativos realizados entre TEP central y periférico, en lo que a signos de sobrecarga de cavidades derechas se refiere (calibre de AP, ratio VD/VI, ratio AP/Ao, modificación de tabique IV y reflujo a VCI o a venas suprahepáticas), arrojaron resultados estadísticamente significativos (p<0,05). En la cohorte pandémica, los TEP centrales se acompañaron con mayor frecuencia que los periféricos de signos de sobrecarga de cavidades cardíacas derechas. Así, del total de TEP periféricos diagnosticados en la cohorte pandémica (n=113), solo el 23% cursaron con calibre AP >30 mm; el 17,7%, con ratio VD/VI >1; el 14,2%, con ratio AP/aorta >1; el 2,7%, con reflujo grave a VCI o suprahepáticas; y menos del 0,1%, con inversión del tabique IV.
4. Discusión
Durante el periodo pandémico se ha observado un incremento considerable en el número de APTC realizadas, que no ha ido acompañado de un aumento paralelo en la incidencia de TEP. Sin embargo, cuando se examinaron los resultados atendiendo a la localización del TEP, se detectó un crecimiento importante en la incidencia de TEP periféricos con respecto a los centrales. Los TEP de localización periférica diagnosticados durante el primer año de pandemia por SARS-CoV-2 se asociaron a menor sobrecarga de cavidades cardíacas derechas e hipertensión pulmonar que los TEP centrales diagnosticados en el mismo intervalo de tiempo.
Se ha reportado un aumento importante en el número de APTC realizadas durante la pandemia de COVID-19, como muestran los resultados de este estudio. Por ejemplo, Tuck AA, et al. observan un incremento del 50% en el número de APTC realizadas en el año 2020 con respecto al 2019. Este dato es similar al incremento del 40% que nuestro estudio ha detectado para períodos de tiempo equiparables (19). Hammer MM y Raptis CA atribuyen este aumento a que, en la literatura, se alertó de manera exagerada sobre el alto riesgo de TEP que supuestamente tenían los pacientes COVID-19. Basan estas declaraciones en el hecho de que la mayoría de APTC realizadas no fueron diagnósticas de TEP (20).
Cuando comparamos la frecuencia de TEP obtenida en la cohorte pandémica de este estudio, que ha sido del 19,6%, observamos que es similar a la detectada en otros trabajos recientes que solo incluyeron a pacientes con infección por SARS-CoV-2 confirmada. El metaanálisis realizado por Suh Y et al. encuentra una incidencia de TEP del 16,5%, aunque ésta osciló entre el 0,7% y el 57% entre los distintos estudios incluidos (21). Interpretar unos datos tan dispares es una tarea compleja. Las diferencias encontradas pueden deberse a que los trabajos publicados hasta el momento son muy heterogéneos, tanto en lo que se refiere a criterios de clasificación de los pacientes como infectados por SARS- CoV-2 como a los de indicación de APTC. En los estudios en los que se realizó APTC de forma protocolizada a todos los pacientes se obtuvo una incidencia de TEP del 30,2%, mientras que aquellos estudios en los que solo algunos pacientes se sometieron a APTC fue del 11,3% (p<0,001) (21).
Hammer MM y Raptis CA, en la carta al editor que envían en respuesta al metaanálisis realizado por Suh YJ et al., destacan que es necesario un contexto para interpretar la incidencia de TEP en pacientes COVID-19 que reportan los diferentes estudios. La mayoría de los trabajos carece de grupo control y los pacientes críticos que, per se, suelen tener un alto riesgo tromboembólico independiente del estatus COVID-19, suponen el grueso de los casos incluidos. Hammer MM y Raptis CA no encontraron diferencias en la incidencia de TEP diagnosticado mediante APTC entre pacientes infectados por SARS-CoV-2 y no infectados (12% versus 9%, respectivamente). Concluyen que aún no existen evidencias suficientes para confirmar que el riesgo de TEP esté aumentado en los pacientes COVID-19 y siembran dudas sobre la implicación que debería concederse al diagnóstico de TEP en el tratamiento de estos pacientes (20).
En nuestro estudio, se detectaron diferencias en la variable edad entre las cohortes prepandémica y pandémica. Aunque pensamos que se trata de una diferencia poco relevante y más bien relacionada con el amplio tamaño muestral del estudio, existen otros trabajos que apuntan en la misma dirección y encuentran diferencias más amplias. Un estudio retrospectivo que solo incluyó a pacientes infectados por SARS-CoV-2 y que fue liderado por Cerdà P et al. concluyó que la edad más joven se comporta como factor de riesgo de TEP en este subgrupo de pacientes. La media de edad del grupo de pacientes COVID-19 sin TEP fue de 69,9 (ds=12,5), mientras que las de aquellos con TEP fue de 63,9 (ds=13,7) (9).
Según los datos de nuestro estudio, el 58% de los TEP diagnosticados en la cohorte pandémica fueron centrales y el 42% periféricos. Existen diferencias significativas (p<0,05) entre ambos grupos en cuanto a la localización del TEP. Aunque existen pocos estudios que clasifiquen los TEP diagnosticados según su localización, el metaanálisis realizado por Suh YJ et al. concluyó que, en los pacientes COVID-19, el TEP se localizó con más frecuencia en zonas periféricas del pulmón (60,4%) que en las arterias pulmonares centrales (39%) (21).
Los resultados obtenidos en cuanto a sobrecarga de cavidades derechas e hipertensión pulmonar en los pacientes con TEP pertenecientes a la cohorte prepandémica no mostraron diferencias entre los TEP centrales y los periféricos. Sin embargo, es difícil extraer conclusiones de estos datos, ya que el número de pacientes diagnosticados de TEP periférico perteneciente a esta cohorte fue muy pequeño (n=8, 6,5%). Por el contrario, sí que se observan diferencias entre los TEP centrales y periféricos diagnosticados durante el primer año de pandemia. De este modo, la mayoría de los TEP periféricos no fueron acompañados de inestabilidad hemodinámica, aunque este dato se ha inferido a partir de criterios puramente radiológicos.
Aún hoy sigue siendo incierto cómo influye en el pronóstico de los pacientes el diagnóstico de TEP periférico, especialmente en los pacientes infectados por SARS-CoV-2 (24). Podría tratarse de infartos pulmonares de pequeño tamaño que no dieran lugar a fallo de ventrículo derecho o inestabilidad hemodinámica. Cabría plantearse si el hecho de que durante la pandemia se haya centrado la atención en el estado protrombótico supuestamente desencadenado por la infección por SARS-CoV-2 podría estar conduciendo al sobrediagnóstico y, por consiguiente, al sobretratamiento de estos pacientes, con las consiguientes consecuencias negativas, como sangrados potencialmente mortales debidos a la potente terapia anticoagulante (25-27).
Cada vez son más los autores que defienden que el verdadero origen de los TEP asociados a la infección por SARS-CoV-2 se encuentra en la inmunotrombosis in situ y no en la clásica fisiopatología del TEP (28-32). Esta hipótesis es refrendada por el hecho de que las lesiones suelen tener menor carga trombótica, con frecuencia no se acompañan de diagnóstico concomitante de TVP (42% frente al 60% que cabría esperar) y tienden a afectar a zonas más periféricas del parénquima pulmonar, que también son las más dañadas por la COVID- 19 (21). Si dicha hipótesis continúa consolidándose, sería oportuno adaptar el algoritmo diagnóstico-terapéutico, validado para el TEP convencional, a las particularidades de esta situación. Además, sería importante valorar si la información disponible hasta el momento sobre el potencial protrombótico de la infección por SARS-CoV-2 podría estar favoreciendo la incurrencia en un sesgo de confirmación. El aumento en la incidencia de TEP periféricos durante la pandemia podría deberse, en parte, a un mayor esfuerzo diagnóstico.
Creemos firmemente que los resultados obtenidos en este trabajo son de gran interés científico. Se trata de un estudio con un amplio tamaño muestral que, además, incluye una cohorte de pacientes a los que se realizó APTC por sospecha de TEP durante la época prepandemia. Incluir un grupo control es una de sus mayores fortalezas, ya que la mayoría de los trabajos similares publicados hasta el momento carecen del mismo, lo cual dificulta la adecuada interpretación de los resultados. Otra de las grandes novedades que introduce este estudio es analizar por separado los casos de TEP según su localización: central o periférica.
En cuanto a las limitaciones de este estudio cabe destacar que la cohorte pandémica podría no ser representativa del conjunto de pacientes COVID-19, ya que incluye a todos los pacientes que se sometieron a APTC por sospecha de TEP, independientemente de su estatus COVID-19. Otra de sus debilidades es inherente a que es un estudio retrospectivo basado en un registro de casos hospitalario que se completó durante el primer año de la pandemia, momento en el que la carga asistencial era elevada y puede haberse producido algún error durante el proceso de recogida de datos. Por último, destacar que no se ha analizado la coexistencia de factores de riesgo trombótico previamente conocidos que podrían haberse comportado como factores de confusión. Además, la prevalencia de dichos factores de riesgo probablemente haya aumentado durante el primer año de la pandemia, especialmente marcado por el confinamiento de la población. Son necesarios más estudios que subsanen en lo posible estas limitaciones y que incorporen, además de variables radiológicas, criterios clínicos que permitan conocer la gravedad y el pronóstico de los pacientes en función de la estrategia terapéutica adoptada.
5. Conclusiones
Hemos detectado un notable aumento en el número de APTC realizadas durante el período pandémico y destaca que no ha venido acompañado de un incremento paralelo en la incidencia de TEP. Sin embargo, si analizamos los resultados según la localización del TEP, observamos que sí ha aumentado la incidencia de TEP periféricos con respecto a los centrales. Además, la mayoría de dichos TEP periféricos no produjeron inestabilidad hemodinámica importante.
Aún no podemos afirmar que el énfasis, probablemente excesivo, que se ha puesto durante la pandemia sobre el potencial protrombótico del SARS-CoV-2 haya contribuido al posible sobrediagnóstico de TEP periféricos. Para ello, son necesarios nuevos estudios que profundicen en esta cuestión.
Declaraciones
Agradecimientos
En primer lugar, queremos expresar nuestro agradecimiento a los organizadores del curso Producción y Traducción de Artículos Científicos Biomédicos, por su paciencia y dedicación, y por haber puesto siempre a nuestra disposición todo su conocimiento y experiencia. Su apoyo y dirección han sido decisivos para la elaboración de este trabajo.
Al servicio de Radiología del Hospital Universitario Virgen de las Nieves por haber aportado la información científica que ha posibilitado la realización de este trabajo de investigación y a todos los trabajadores, sanitarios y no sanitarios, que a diario se enfrentan a esta emergencia global.
Conflictos de interés
Manuel González Alcaide es el editor jefe de esta revista.
Financiación
No se dispone de financiación para la realización del presente estudio.
Referencias
1. Uresandi F, Monreal M, García-Bragado F, Domenech P, Lecumberri R, Escribano P, et al. Consenso nacional sobre el diagnóstico, estratificación de riesgo y tratamiento de los pacientes con tromboembolia Archivos de Bronconeumología. 2013;49(12):534-547.
2. Huisman MV, Barco S, Cannegieter SC, et al. Pulmonary Nat Rev Dis Primers. 2018;17(4):5-8.
3. Demelo-Rodríguez P, Cervilla-Muñoz E, Ordieres-Ortega L, Parra-Virto A, Toledano-Macías M, Toledano-Samaniego N, et al. Incidence of asymptomatic deep vein thrombosis in patients with COVID-19 pneumonia and elevated D-dimer Thromb Res. 2020;192:23–26.
4. Láinez-Ramos-Bossini AJ, Moreno-Suárez S, Pérez-García MC, Gálvez-López R, Garrido-Sanz F, Rivera- Izquierdo M. Use of clinical probability scores and D-dimer in suspected pulmonary embolism. Results from a Spanish retrospective European Journal of Emergency Medicine. 2020;27(6):468-469.
5. Láinez-Ramos-Bossini AJ, Moreno-Suárez S, Pérez-García MC, Gálvez-López R, Sanz FG, Rivera- Izquierdo Acute pulmonary embolism: appropriateness of emergency department management according to clinical guidelines. Tromboembolismo pulmonar agudo: adecuación del manejo de pacientes según las guías de práctica clínica en el servicio de urgencias. Radiologia. 2020;S0033- 8338(20):1-9.
6. Stals MAM, Kaptein FHJ, Kroft LJM, Klok FA, Huisman Challenges in the diagnostic approach of suspected pulmonary embolism in COVID-19 patients. Postgraduate Medicine. 2021;133:36–41.
7. Karimzadeh S, Raut A, Huy NT. COVID-19 and pulmonary embolism: Diagnostic imaging trends. Journal of Nuclear Society of Nuclear Medicine Inc. 2020;61:1102.
8. Van Es N, Van Der Hulle T, Van Es J, Den Exter PL, Douma RA, Goekoop RJ, et al. Wells rule and d-dimer testing to rule out pulmonary embolism: a systematic review and individual-patient data meta-analysis. Ann Intern 2016;165(4):253–261.
9. Cerdà P, Ribas J, Iriarte A, Mora-Luján JM, Torres R, del Río B, et Blood test dynamics in hospitalized COVID-19 patients: Potential utility of D-dimer for pulmonary embolism diagnosis. PLoS ONE. 2020;15:1-15.
10. Tang N, Li D, Wang X, Sun Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-847.
11. Garcia-Olivé I, Sintes H, Radua J, et al. D-dimer in patients infected with COVID-19 and suspected pulmonary Respir Med. 2020;169:106023.
12. Ippolito D, Capodaglio C, Maino C, Corso R, Leni D, Fior D, et al. Compressive ultrasound can predict early pulmonary embolism onset in COVID patients. Journal of 2022:1-7.
13. Yoo HH, Nunes-Nogueira VS, Fortes Villas Boas Anticoagulant treatment for subsegmental pulmonary embolism. Cochrane Database Syst Rev. 2020;2(2):10-22.
14. Carrier M, Klok Symptomatic subsegmental pulmonary embolism: to treat or not to treat?. Hematology Am Soc Hematol Educ Program. 2017;2017(1):237-241.
15. Baumgartner C, Tritschler T. Clinical significance of subsegmental pulmonary embolism: An ongoing Res Pract Thromb Haemost. 2020;5(1):14-16.
16. Helms J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089–1098.
17. Poissy J, Goutay J, Caplan M, et al. Pulmonary embolism in patients with COVID-19: awareness of an increased Circulation. 2020;142(2):184–186.
18. Roncon L, Zuin M, Barco S, Valerio L, Zuliani G, Zonzin P, et al. Incidence of acute pulmonary embolism in COVID- 19 patients: systematic review and meta-analysis. Eur J Intern 2020;82:29–37
19. Tuck AA, White HL, Abdalla BA, Cartwright GJ, Figg KR, Murphy EN, et al. To scan or not to scan – D-dimers and computed tomography pulmonary angiography in the era of COVID-19. Clin Med (Lond). 2021;21(2):155-160.
20. Hammer MM, Raptis CA. COVID-19 and Pulmonary Radiology. 2021;299(2):252.
21. Suh YJ, Hong H, Ohana M, Bompard F, Revel MP, Valle C, et al. Pulmonary Embolism and Deep Vein Thrombosis in COVID-19: A Systematic Review and Meta-Analysis. Vol. 298, Radiology. Radiological Society of North America Inc. 2021;298:70–80.
22. Léonard-Lorant I, Delabranche X, Séverac F, Helms J, Pauzet C, Collange O, et al. Acute Pulmonary Embolism in Patients with COVID-19 at CT Angiography and Relationship to d-Dimer Radiology. 2020;296(3):189-191.
23. Poyiadji N, Cormier P, Patel PY, Hadied MO, Bhargava P, Khanna K, et al. Acute Pulmonary Embolism and COVID-19. 2020;297(3):335-338.
24. Valle C, Bonaffini PA, Dal Corso M, Mercanzin E, Franco PN, Sonzogni A, et al. Association between pulmonary embolism and COVID-19 severe pneumonia: Experience from two centers in the core of the infection Italian peak. Eur J Radiol. 2021;137:6-13.
25. Halaby R, Cuker A, Yui J, et al. Bleeding risk by intensity of anticoagulation in critically ill patients with COVID-19: A retrospective cohort J Thromb Haemost. 2021;19(6):1533-1545.
26. Cheruiyot I, Sehmi P, Ominde B, Bundi P, Mislani M, Ngure B, Olabu B, Ogeng’o JA. Intracranial hemorrhage in coronavirus disease 2019 (COVID-19) patients. Neurol 2021;42(1):25-33.
27. Beyrouti R, Best JG, Chandratheva A, Perry RJ, Werring Characteristics of intracerebral haemorrhage associated with COVID-19: a systematic review and pooled analysis of individual patient and aggregate data. J Neurol. 2021;268(9):3105-3115.
28. van Dam LF, Kroft LJM, van der Wal LI, Cannegieter SC, Eikenboo m J, de Jonge E, et al. Clinical and computed tomography characteristics of COVID-19 associated acute pulmonary embolism: A different phenotype of thrombotic disease? Thrombosis Research. 2020;193:86–89
29. Meiler S, Hamer OW, Schaible J, Zeman F, Zorger N, Kleine H, et al. Computed tomography characterization and outcome evaluation of COVID-19 pneumonia complicated by venous PLoS ONE. 2020;15:1-16.
30. Bonaventura A, Vecchié A, Dagna L, Martinod K, Dixon DL, Van Tassell BW, et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19. Nat Rev 2021;21(5):319-329.
31. Shaw RJ, Bradbury C, Abrams ST, Wang G, Toh CH. COVID-19 and immunothrombosis: emerging understanding and clinical management. Br J Haematol. 2021;194(3):518-529.
32. Henry BM, Vikse J, Benoit S, Favaloro EJ, Lippi G. Hyperinflammation and derangement of renin-angiotensin- aldosterone system in COVID-19: A novel hypothesis for clinically suspected hypercoagulopathy and microvascular Clin Chim Acta. 2020;507:167-173.
AMU 2022. Volumen 4, Número 1
Fecha de envío: Fecha de aceptación: Fecha de publicación:
23/03/2022 04/04/2022 31/05/2022
Cita el artículo: Carrasco-Cáliz A, Ruiz-del-Pino M, González-Alcaide M. Diagnóstico del tromboembolismo pulmonar en la práctica clínica. Status quo previo a la pandemia del COVID-19 en un hospital terciario. AMU. 2022; 4(1): 7-18.
