Rodríguez-Escalera, Eyder Álex¹ ²; Raya-Porres, Ignacio Jerónimo ³; García-Millán, Laura¹ ² *; Del-Moral-Ojeda, Ernesto³
¹ Facultad de Medicina de la Universidad de Granada
² Alumno Interno del Dpto. de Histología de la Facultad de Medicina. Universidad de Granada
³ Facultad de Farmacia de la Universidad de Granada
* Autor de correspondencia: lauragar1127@gmail.com
Resumen
El síndrome de ovario poliquístico es una enfermedad hormonal muy frecuente en mujeres de edad fértil. Se caracteriza por una sintomatología relacionada con menstruaciones irregulares, aumento de peso o hiperandrogenismo, entre otros. Actualmente no se refiere un tratamiento específico para tratar este padecimiento; sino que se basa en el tratamiento de su sintomatología. Sin embargo, el uso de alimentos está tomando cada vez más relevancia para este fin. En este trabajo se ha hecho un análisis de la dieta mediterránea y las dietas asiáticas, seleccionando alimentos típicos representativos de estas: aceite de oliva, legumbres y leche y jengibre, té verde, soja y espirulina, respectivamente. Tras el estudio de diversa bibliografía científica, se ha concluido que estos alimentos ayudan a paliar los síntomas del síndrome de ovario poliquístico. Más concretamente aquellos relacionados con las menstruaciones irregulares, el aumento de peso y la infertilidad. A pesar de esto, es necesaria una mayor evidencia sobre estas dietas para poder incorporarlas en el tratamiento no farmacológico de este síndrome.
Palabras clave: SOP, terapia nutricional, infertilidad femenina, signos y síntomas, dieta.
Abstract
The polycystic ovary syndrome is a very common condition in women of childbearing age. It is characterised by symptoms such as irregular menstruation, weight gain, and hyperandrogenism, among others. At present, there is no specific treatment for this condition; instead, treatment is based on managing the symptoms. However, the use of diet is becoming increasingly important. This study analyses the Mediterranean diet and Asian diets, selecting typical foods representative of these diets: olive oil, legumes and milk and ginger, green tea, soy, and spirulina, respectively. After reviewing a wide range of scientific literature, it was concluded that these foods help to alleviate the symptoms of polycystic ovary syndrome, particularly those associated with irregular menstruation, weight gain and infertility. However, more evidence is needed before these diets can be included in the non-pharmacological management of the syndrome.
Keywords: PCOS, nutritional therapy, female infertility, signs and symptoms, diet.
1. Introducción
El síndrome de ovario poliquístico (SOP) es una de las alteraciones hormonales más frecuentes en mujeres en edad fértil, entre el 6% y el 13% lo padecen (1). No tiene una causa conocida, aunque hay estudios que proponen que podría guardar relación con algunos polimorfismos de genes como rFHS (2), hiperinsulinemia y otros factores ambientales (3). Algunos de los síntomas más destacados son menstruaciones irregulares, hirsutismo, esterilidad, obesidad, acné, hiperandrogenismo, etc (Figura 1).
Figura 1. Manifestaciones clínicas del síndrome de ovario poliquístico
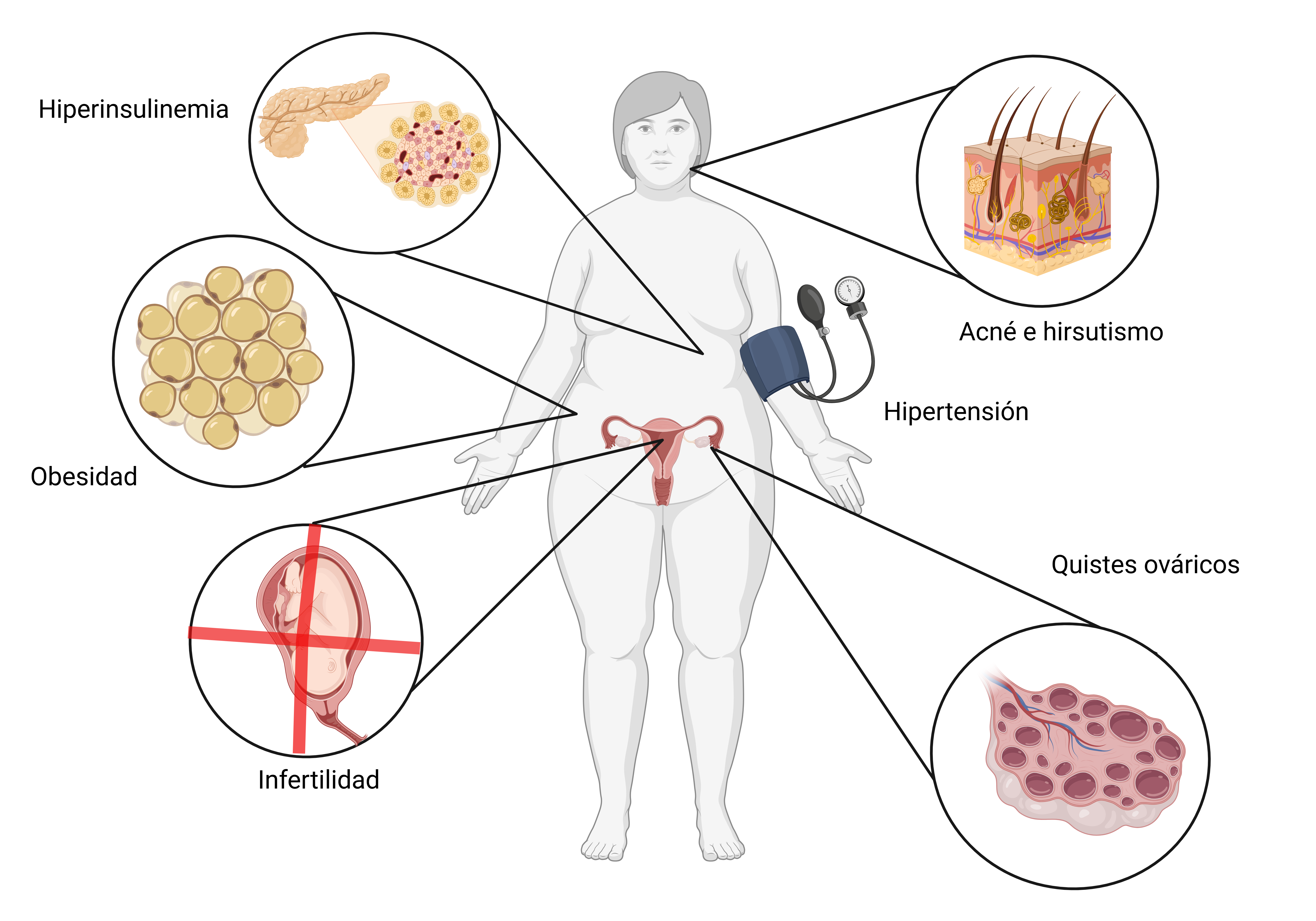
También supone un mayor riesgo de padecer diversas enfermedades con repercusión cardiovascular como hipertensión, diabetes mellitus, hipercolesterolemia, etc (1). Para el diagnóstico de SOP, hay varios criterios disponibles, aunque los más usados corresponden a los Criterios de Rotterdam (4). Estos dictan que se deben cumplir 2 de las siguientes 3 características: hiperandrogenismo (clínico o bioquímico), anovulación u oligoovulación y evidencia de ovarios poliquísticos (por ejemplo, por ecografía) (4). No se dispone de un tratamiento específico que permita la curación de esta afectación, sino que se tienden a hacer intervenciones para paliar los síntomas de cada paciente. Por un lado, una intervención farmacológica ampliamente usada son los anticonceptivos orales, que regulan el ciclo menstrual, entre otros efectos (5). Otros fármacos usados son sensibilizadores de insulina, antagonistas de andrógenos, etc. (6) Por otro lado, intervenciones no farmacológicas tales como mantenimiento de un adecuado estilo de vida, definido como dieta equilibrada y actividad física, pueden aportar una mejora de los síntomas, en especial los relacionados con el riesgo CV (1,7). La dieta mediterránea es ampliamente conocida por sus efectos protectores en la salud (8). Nuestro objetivo es conocer cuáles son los beneficios de la dieta asiática con respecto a la mediterránea en el control de los síntomas del SOP, ya que, a pesar de la gran prevalencia de esta alteración entre las mujeres en edad fértil, no existen demasiadas certezas sobre su tratamiento y abordaje desde el punto de vista nutricional. Con esta revisión narrativa pretendemos recopilar la información existente sobre ambas dietas en relación al SOP.
2. Influencia de la dieta en la salud ginecológica
Las dietas tienen una gran influencia sobre la salud, ya que en los alimentos encontramos la energía y otros tipos de nutrientes que permiten un buen funcionamiento de nuestro cuerpo. Si no hay un aporte correcto de todos los nutrientes, esto lleva a un mal estado de salud, ya sea por exceso o deficiencia de estos compuestos que nos aportan los alimentos. Por otra parte, hay una gran relación entre los alimentos consumidos y la salud del aparato reproductor femenino, ya que la dieta de una persona influye en el retraso de la aparición de la menopausia y por lo tanto en el aumento de la vida reproductiva de la mujer (9). Dentro de una de las muchas afecciones del aparato reproductor femenino, se encuentra el SOP, con numerosos síntomas. Estos pueden disminuirse con una buena alimentación, ya que hay una gran cantidad de alimentos con determinadas características que pueden ser usados para tratar enfermedades crónicas (10). El SOP, al encontrarse dentro de este grupo de enfermedades, podría ser candidato para la utilización de alimentos para paliar sus síntomas.
2.1. Dieta mediterránea
La dieta mediterránea (MDIET) ha estado ganando reconocimiento y reputación en la comunidad científica debido a sus numerosos beneficios para la salud. Este auge, sin duda alguna, ha sido paralelo a la preocupación por los problemas de obesidad y sedentarismo en la sociedad actual, pues numerosos artículos comprueban que la MDIET contribuye a bajar los niveles de resistencia a la insulina, perfiles lipídicos e inflamación crónica gracias a alimentos como el aceite de oliva, las legumbres o las frutas y verduras frescas (11). Todos estos hacen que sea una dieta hipocalórica y rica en macro y micronutrientes de buena calidad. Dentro de la dieta mediterránea, hay una serie de alimentos que son muy representativos, de los cuales destacamos tres: el aceite de oliva, las legumbres y la leche y sus derivados (Tabla 1).
Tabla 1. Resumen y comparación de los principales beneficios de los alimentos de la dieta mediterránea y las dietas asiáticas
| Alimentos de la dieta mediterránea | Beneficios |
| Aceite de oliva | Evita hipertensión, regula el peso corporal y mejora el perfil lipídico. |
| Legumbres | Reducen el índice glucémico, reducen la resistencia a la insulina, descienden el nivel de colesterol, obesidad, tensión arterial y la inflamación |
| Leche y productos lácteos | Evita problemas cardíacos, reduce el peso corporal y la resistencia a la insulina. |
| Alimentos de las dietas asiáticas | Beneficios |
| Jengibre | Regulación y control de hormonas sexuales y glucemia. |
| Té verde y otras infusiones | Reduce el peso corporal, disminuye la glucemia y niveles de andrógenos. |
| Espirulina | Aumenta la sensibilidad a la insulina, regula el peso corporal. |
| Soja | Reduce el índice glucémico, la obesidad, mantiene la densidad ósea, mejora valores hormonales y tiene poder antioxidante y antiinflamatorio. |
2.1.1. Aceite de oliva
El aceite de oliva es uno de los principales ingredientes de la dieta mediterránea. Es muy utilizado en una gran cantidad de elaboraciones. Está formado por numerosos ácidos grasos monoinsaturados, entre los que destaca el ácido oleico. También encontramos otros compuestos como fitoesteroles, compuestos fenólicos y ergosterol (12). Para el tratamiento del SOP, el aceite de oliva demuestra ser beneficioso. La primera ventaja es su capacidad para evitar enfermedades cardíacas. Su consumo reveló una disminución de los parámetros de riesgo de las mismas, como la interleucina-6 (IL-6), el cual también es un mediador proinflamatorio (13). Por otra parte, debido a su composición química, es capaz de reducir las lipoproteínas de baja densidad (LDL-c) y aumentar las de alta densidad (HDL-c). Esto produce una disminución en la formación de trombos en el sistema circulatorio, disminuyendo los principales síntomas como la hipertensión o hipercolesterolemia, y evitando así otros problemas graves como los infartos (13), al regular el perfil lipídico.
2.1.2. Legumbres
Las legumbres son uno de los pilares alimenticios de la MDIET, estando presentes como fuente de carbohidratos complejos de bajo índice glucémico y proteína vegetal. Para poner en contexto el amplio uso de las legumbres, en España se consumieron 3,3 kilogramos de legumbres per cápita en 2023. Para ser más exactos, 1,4 fueron legumbres secas y 1,9 legumbres cocidas. De esos 3,3 kilogramos, 0,9 fueron alubias, 0,9 lentejas y 1,4 garbanzos (14). Estas legumbres realizan una importante función en la reducción de síntomas presentes en el SOP, como la resistencia a la insulina, inflamación o alto perfil lipídico. Debido a sus componentes, una dieta con una importante presencia de las legumbres tiene efectos positivos sobre la resistencia a la insulina, reduciendo el índice glucémico postprandial, los excesos de colesterol y la obesidad, así como la inflamación y la presión arterial (15).
2.1.3. Leche y productos lácteos
Uno de los pilares de la dieta mediterránea es el consumo de leche y derivados, como el queso y el yogur. Todos estos alimentos, además de tener buenas propiedades organolépticas, poseen numerosos beneficios. Hay estudios que asocian el consumo de productos lácteos con una disminución de los problemas cardíacos y también en la disminución de la mortalidad de enfermedades cardiovasculares mediante la disminución de fosfolípidos y LDL-c (16). A pesar de contener una gran cantidad de ácidos saturados, este fenómeno de reducción de lípidos en sangre se puede explicar por una acción conocida como la matriz de un alimento. Se basa en que los ácidos grasos saturados no producen enfermedades cardiacas por sí mismos, sino que los efectos en la salud de diversas moléculas varían según se encuentren unidos en la matriz del alimento (17). Además, se ha observado que el calcio contenido en los alimentos de origen lácteo reduce la presión en los movimientos de sístole y diástole del corazón, además de aumentar la cantidad de HDL-c en sangre (18). Todo esto produce una mejora en complicaciones cardíacas como la hipertensión, ayudando a mitigar unos de los síntomas del SOP. Los productos lácteos son ventajosos contra la obesidad y la diabetes tipo 2. Diversos estudios han observado que el yogur ofrece numerosos beneficios para el control del perfil glucémico (18). Es más, en un experimento se demostró que tiene propiedades que reducen el sobrepeso y la obesidad abdominal (18). Otros metaanálisis han demostrado que un consumo de productos lácteos fermentados disminuye la posibilidad de desarrollar diabetes tipo 2 (18).
2.2. Dietas asiáticas
Algunos alimentos característicos de esta dieta que han demostrado que pueden tener beneficios en el control de los síntomas de SOP son: soja, jengibre, té verde, espirulina, etc.
2.2.1. Jengibre
Actualmente, el jengibre es un condimento consumido en todo el mundo. Especialmente, es muy popular en Asia, donde se usa como aderezo y remedio a numerosos padecimientos desde hace miles de años (19). Con relación al SOP, hay estudios que le atribuyen funciones en la regulación de hormonas sexuales. Uno demostró que la administración de dosis altas de jengibre en ratas con SOP ayudaba al equilibrio de las hormonas sexuales. Además, así se conseguían evitar los efectos adversos de otros fármacos usados para este fin, ya que esta cantidad de jengibre no suponía riesgo alguno (20). Este puede resultar beneficioso para la disminución de SHBG, FSH y LH en pacientes con síndrome de ovario poliquístico (21). Por otro lado, el síndrome de ovario poliquístico implica una mayor probabilidad de sufrir obesidad y síndrome metabólico en las mujeres que lo padecen (22). El jengibre ha demostrado contribuir al mejor control de la glucemia y dislipemia propios del síndrome metabólico (23). En pacientes con SOP, también se observa este efecto, y, además, un papel en la reducción del estrés oxidativo y la inflamación asociados con esta alteración (24).
2.2.2. Té verde
El té, y en especial el té verde, es de las bebidas más populares en países asiáticos como China (25). Proviene de la planta Camellia sinensis y entre sus componentes principales se encuentran los polifenoles, destacando las catequinas (26). Se le atribuyen múltiples beneficios en torno a diversas enfermedades. Por ejemplo, se han descrito sus efectos favorables en la carcinogénesis, ya que estos polifenoles instigan la muerte de células apoptóticas y la detención del ciclo celular de células malignas (26). En cuanto al SOP, también se ha investigado la relación entre el consumo de catequinas y la mejora en los parámetros metabólicos y hormonales. Las catequinas tienen función inhibidora sobre la catecol-O-metiltransferasa (COMT), que es la enzima encargada de la degradación de noradrenalina (NA), entre otras. Este neurotransmisor tiene efecto lipolítico y termogénico, lo que explicaría una posible relación entre la pérdida de peso y el consumo de té verde (27). Aun así, este beneficio no está del todo claro, al haber resultados dispares en los diferentes estudios. Por ejemplo, un estudio realizado en mujeres asiáticas con IMC alto y SOP mostró que el consumo de té verde no supone mejora alguna en cuanto al perfil metabólico o peso de estas pacientes. Sin embargo, sí se observó un cierto aumento de triglicéridos en el grupo de intervención (28). En el perfil hormonal de pacientes con SOP encontramos un aumento de las hormonas sexuales como LH o FSH, además de hiperandrogenismo (29). Este guarda relación con los niveles aumentados de insulina, la cual induce, por varios mecanismos, el aumento de testosterona. Por ello, la reducción de esta hiperinsulinemia tiene efectos reductores en los niveles de andrógenos. La toma de té verde ha resultado beneficiosa para este objetivo (30).
2.2.3. Soja
La soja es un alimento muy común en la cocina asiática, presente de muchas formas. Se puede tomar crudo, como leche de soja, tofu… y se caracteriza por estar compuesta por distintas sustancias: lecitinas, proteína de la soja y fitoesteroles, donde encontramos a las isoflavonas, entre otros (31). Las isoflavonas son unas partículas muy parecidas a los estrógenos capaces de unirse a sus mismos receptores. Es por ello que las isoflavonas tienen efectos anti-obesidad, reducción de los niveles de glucosa en sangre y antioxidantes, además de ser beneficiosas para el mantenimiento de la densidad ósea (31). Recientes estudios en relación con el SOP han establecido que el consumo de soja durante al menos 12 semanas mejoró la resistencia a la insulina y mejoró los valores hormonales y de triglicéridos (32). En el grupo de mujeres que por su microbiota pueden sintetizar equol, un derivado de las isoflavonas, se evidenció la presencia de niveles más bajos de andrógenos y una mejor fertilidad (33). Por otra parte, también se demostró que suponen una mejora del estrés oxidativo y del metabolismo de la glucosa y lípidos (32). Es decir, son beneficiosas para la pérdida de peso. En cuanto a la morfología del ovario, disminuye su tamaño y mejora la regularidad del ciclo menstrual (34).Por lo tanto, se puede afirmar una relación positiva entre el consumo de soja y mejora en la menstruación y fertilidad. Las isoflavonas también son capaces de inhibir la activación de la vía NF-kB en la inflamación presente en las mujeres con SOP. Esto corrobora su papel antiinflamatorio y antioxidante (34). De esta forma, son evidentes los beneficios encontrados para los niveles de glucosa, hormonas (32) y sintomatología del SOP (33,34). El tofu es un alimento muy nutritivo y fisiológicamente beneficioso proveniente de China (35). Es resultado de la fermentación de la soja. Tiene muchos beneficios cardiovasculares, para la hipertensión o diabetes. Al ser un derivado de la soja y por su procesamiento, contiene mayor cantidad de isoflavonas que la soja natural (35,36). Esta mayor cantidad de isoflavonas y componentes del tofu, reducen significativamente el peso corporal y el índice de masa corporal, además de regular los niveles colesterol (37), siendo muy buena su incorporación en la dieta para la reducción de sintomatología propia del SOP (37). En un estudio clínico, se evaluaron los niveles de testosterona en mujeres que consumían productos basados en soja, como el tofu, y se apreció una reducción de los niveles de testosterona (38), beneficioso para los síntomas asociados a ese hiperandrogenismo (38). A pesar de ello, hay hallazgos que evidencian lo contrario (39).
2.2.4. Espirulina
La espirulina es un alga rica en proteínas y vitaminas, de morfología filamentosa (40). Es muy usada en la cocina asiática por sus propiedades antiinflamatorias, antioxidantes e inmunomoduladoras evidenciadas en animales y humanos (41). Por mucho tiempo ha sido usada como un suplemento dietético por su eficiencia en el tratamiento de la diabetes mellitus tipo 2 (40). Es por ello que es capaz de modular el índice de masa corporal, mejorar el perfil lipídico y el peso corporal (41). En relación con el SOP, vemos cómo la modulación de los síntomas es significativa. Esto se debe a la normalización de los valores hormonales característicos del SOP: FSH, LH y andrógenos (41); y a la mejora de los parámetros relacionados con el metabolismo de la glucosa, más concretamente, con la resistencia a la insulina. Se ha visto que la espirulina es capaz de mejorar la sensibilidad a la insulina en un 20\%, demostrado por una sobreexpresión de dos genes relacionados con la glucólisis (41). Permite una reducción de la masa corporal y una estabilización de los parámetros hepáticos y masa grasa hepática (41). Además, histológicamente se observa un aumento general de los folículos primordiales y una disminución en la cantidad de folículos atrésicos y quistes (41). En estudios inmunológicos, se observa una mayor expresión del marcador Ki-67 en el antro de las células de la granulosa de folículos en crecimiento, por lo que podemos asumir que hay una mejoría de la menstruación y de la capacidad reproductiva (41). Cabe mencionar que estos hallazgos han sido evidenciados en estudios con ratas (40,41).
3. Conclusión
Como conclusión, todos los alimentos estudiados en este artículo tienen potencial para mejorar los síntomas del SOP, ya sea mediante el control del peso, síntomas cardiovasculares o regulación hormonal. Sin embargo, se necesita mayor evidencia y estudios para poder incorporar estos alimentos en el tratamiento de las pacientes. No debe olvidarse, además, la toma de otras medidas generales para mejorar la salud como el ejercicio físico.
Declaraciones
Conflictos de interés
Los autores no destacan ningún conflicto de interés.
Financiación
Los autores no tuvieron ninguna financiación.
Referencias
1. Síndrome del ovario poliquístico [Internet]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/polycystic-ovary-syndrome
2. Ajmal N, Khan SZ, Shaikh R. Polycystic ovary syndrome (PCOS) and genetic predisposition: A review article. Eur J Obstet Gynecol Reprod Biol X. 2019;3:100060.
3. Chen DJ, Ding R, Cao JY, Zhai JX, Zhang JX, Ye DQ. Two follicle-stimulating hormone receptor polymorphisms and polycystic ovary syndrome risk: a meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2014;182:27-32.
4. Guía de práctica clínica de síndrome de ovario poliquístico [Internet]. [citado 13 de marzo de 2025]. Disponible en: https://www.archivosdemedicina.com/medicina-de-familia/guia-de-practica-clinica-de-sindrome-de-ovario-poliquistico.pdf
5. Bednarska S, Siejka A. The pathogenesis and treatment of polycystic ovary syndrome: What’s new? Adv Clin Exp Med. 2017;26(2):359-67.
6. Di Lorenzo M, Cacciapuoti N, Lonardo MS, Nasti G, Gautiero C, Belfiore A, et al. Pathophysiology and Nutritional Approaches in Polycystic Ovary Syndrome (PCOS): A Comprehensive Review. Curr Nutr Rep. 2023;12(3):527-44
7. Faghfoori Z, Fazelian S, Shadnoush M, Goodarzi R. Nutritional management in women with polycystic ovary syndrome: A review study. Diabetes Metab Syndr Clin Res Rev. 2017;11:S429-32.
8. Sikalidis AK, Kelleher AH, Kristo AS. Mediterranean Diet. Encyclopedia. 2021;1(2):371-87.
9. Cavalcante MB, Sampaio OGM, Cámara FEA, Schneider A, de Ávila BM, Proszcek J, et al. Ovarian aging in humans: potential strategies for extending reproductive lifespan. GeroScience. 2023;45(4):2121-33.
10. Greenway FL. Food as Medicine for Chronic Disease: A Strategy to Address Non-Compliance. J Med Food. 2020;23(9):903-4.
11. Barrea L, Amone A, Annunziata G, Muscogiuri G, Laudisio D, Salzano C, et al. Adherence to the Mediterranean Diet, Dietary Patterns and Body Composition in Women with Polycystic Ovary Syndrome (PCOS). Nutrients. 2019;11(10):2278.
12. Romani A, Ieri F, Urciuoli S, Noce A, Marrone G, Nediani C, et al. Health Effects of Phenolic Compounds Found in Extra-Virgin Olive Oil, By-Products, and Leaf of Olea europaea L. Nutrients. 2019;11(8):1776.
13. Marcelino G, Hiane PA, Freitas K de C, Santana LF, Pott A, Donadon JR, et al. Effects of Olive Oil and Its Minor Components on Cardiovascular Diseases, Inflammation, and Gut Microbiota. Nutrients. 2019;11(8):1826.
14. Alimentación en España [Internet]. Mercasa; [citado 18 de marzo de 2025]. Disponible en: https://www.mercasa.es/publicaciones/alimentacion-en-espana/
15. Kazemi M, McBreatiry LE, Chizen DR, Pierson RA, Chilibeck PD, Zello GA. A Comparison of a Pulse-Based Diet and the Therapeutic Lifestyle Changes Diet in Combination with Exercise and Health Counselling on the Cardio-Metabolic Risk Profile in Women with Polycystic Ovary Syndrome: A Randomized Controlled Trial. Nutrients. 2018;10(10):1387.
16. Rizzoli R, Biver E. Role of fermented dairy products in the health benefits of a Mediterranean diet. Aging Clin Exp Res. 2024;36:75.
17. Geiker NRW, Mølgaard C, Iuliano S, Rizzoli R, Manios Y, van Loon LJC, et al. Impact of whole dairy matrix on musculoskeletal health and aging: current knowledge and research gaps. Osteoporos Int. 2020;31(4):601-15.
18. Rizzoli R, Biver E. Role of fermented dairy products in the health benefits of a mediterranean diet. Aging Clin Exp Res. 2024;36(1):75.
19. Siedentopp U. El jengibre, una planta medicinal eficaz como medicamento, especia o infusión. Rev Int Acupunct. 2008;2(3):188-92.
20. Atashpour S, Kargar Jahromi H, Kargar Jahromi Z, Maleknasab M. Comparison of the effects of Ginger extract with clomiphene citrate on sex hormones in rats with polycystic ovarian syndrome. Int J Reprod Biomed. 2017;15(9):561-8.
21. Dastgheib M, Barati-Boldaji R, Bahrampour N, Taheri R, Borghei M, Amooe S, et al. A comparison of the effects of cinnamon, ginger, and metformin consumption on metabolic health, anthropometric indices, and sexual hormone levels in women with poly cystic ovary syndrome: A randomized double-blinded placebo-controlled clinical trial. Front Nutr. 2022;9:1071515.
22. Mandrelle K, Kamath M, Bondu D, Chandy A, Aleyamma T, George K. Prevalence of metabolic syndrome in women with polycystic ovary syndrome attending an infertility clinic in a tertiary care hospital in south India. J Hum Reprod Sci. 2012;5(1):26.
23. Mackonochie M, Rodriguez-Mateos A, Mills S, Rolfe V. A Scoping Review of the Clinical Evidence for the Health Benefits of Culinary Doses of Herbs and Spices for the Prevention and Treatment of Metabolic Syndrome. Nutrients. 2023;15(23):4867.
24. Novakovic S, Jakovljevic V, Jovic N, Andric K, Milinkovic M, Anicic T, et al. Exploring the Antidiabetic Effects of Ginger and Cinnamon: A Comprehensive Review of Evidence and Molecular Mechanisms Involved in Polycystic Ovary Syndrome (PCOS) and Other Oxidative Stress-Related Disorders. Antioxidants. 2024;13(4):392.
25. Khan N, Mukhtar H. Tea Polyphenols in Promotion of Human Health. Nutrients. 2018;11(1):39.
26.Chen D, Wan SB, Yang H, Yuan J, Chan TH, Dou QP. EGCG, GREEN TEA POLYPHENOLS AND THEIR SYNTHETIC ANALOGS AND PRODRUGS FOR HUMAN CANCER PREVENTION AND TREATMENT. Adv Clin Chem. 2011;53:155-77.
27. Ashkar F, Rezaei S, Salahshoornezhad S, Vahid F, Gholamalizadeh M, Dahka SM, et al. The Role of medicinal herbs in treatment of insulin resistance in patients with Polycystic Ovary Syndrome: A literature review. Biomed Concepts. 2019;11(1):57-75.
28. Chan CCW, Koo MWL, Ng EHY, Tang OS, Yeung WSB, Ho PC. Effects of Chinese green tea on weight, and hormonal and biochemical profiles in obese patients with polycystic ovary syndrome–a randomized placebo-controlled trial. J Soc Gynecol Investig. 2006;13(1):63-8.
29. Maleki V, Taheri E, Varshosaz P, Tabrizi FPF, Moludi J, Jafari-Vayghan H, et al. A comprehensive insight into effects of green tea extract in polycystic ovary syndrome: a systematic review. Reprod Biol Endocrinol. 2021;19(1):147.
30. Ghafurniyan H, Azarnia M, Nabiuni M, Karimzadeh L. The Effect of Green Tea Extract on Reproductive Improvement in Estradiol Valerate-Induced Polycystic Ovarian Syndrome in Rat. Iran J Pharm Res IJPR. 2015;14(4):1215-33.
31. Health Promotion Effects of Soy Isoflavones [Internet]. [citado 18 de marzo de 2025]. Disponible en: https://www.jstage.jst.go.jp/article/jsnsv/66/6/66_02/_article
32. Jamilian M, Asemi Z. The Effects of Soy Isoflavones on Metabolic Status of Patients With Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2016;101(9):3386-94.
33. Haudum C, Lindheim L, Ascani A, Trummer C, Horvath A, Münzker J, et al. Impact of Short-Term Isoflavone Intervention in Polycystic Ovary Syndrome (PCOS) Patients on Microbiota Composition and Metagenomics. Nutrients. 2020;12(6):1622.
34. Soy isoflavones alleviate polycystic ovary syndrome in rats by regulating NF-κB signaling pathway [Internet]. [citado 18 de marzo de 2025]. Disponible en: https://www.tandfonline.com/doi/full/10.1080/21655979.2021.1979864
35. Zheng L, Regenstein JM, Teng F, Li Y. Tofu products: A review of their raw materials, processing conditions, and packaging. Compr Rev Food Sci Food Saf. 2020;19(6):3683-3714.
36. Zaheer K, Humayoun Akhtar M. An updated review of dietary isoflavones: Nutrition, processing, bioavailability and impacts on human health. Crit Rev Food Sci Nutr. 2017;57(6):1280-93.
37. Karamali M, Kashanian M, Alaeinasab S, Asemi Z. The effect of dietary soy intake on weight loss, glycaemic control, lipid profiles and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome: a randomised clinical trial. J Hum Nutr Diet. 2018;31(4):533-43.
38. Zilaee M, Mansoori A, Hosseini SM, Mohaghegh SM, Asadi M, Hormoznejad R. The effects of soy isoflavones on total testosterone and follicle-stimulating hormone levels in women with polycystic ovary syndrome: a systematic review and meta-analysis. Eur J Contracept Reprod Health Care. 2020;25(4):305-10.
39. Patisaul HB, Mabrey N, Adewale HB, Sullivan AW. Soy but not bisphenol A (BPA) induces hallmarks of polycystic ovary syndrome (PCOS) and related metabolic co-morbidities in rats. Reprod Toxicol. 2014;49:209-18.
40. Camerlingo C. Spirulina therapeutic potentiality in polycystic ovarian syndrome management using DHEA-induced rat model [Internet]. European Review. 2022 [citado 18 de marzo de 2025]. Disponible en: https://www.europeanreview.org/article/28604
41. El Leithy AA, Abozaid M, Al-Karmalawy AA, Mahmoud Allam R, Nourelden AZ, Amer RM, et al. Spirulina versus metformin for controlling some insulin signaling pathway genes in induced polycystic ovary syndrome rat model. Gene. 2024;921:148524.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 26/01/2025
Fecha de revisión: 09/02/2025
Fecha de aceptación: 29/03/2025
Cita el artículo: Rodríguez-Escalera EA, Raya-Porres IJ, García-Millán L, Del-Moral-Ojeda E. Asociación entre la dieta mediterránea y las dietas asiáticas en la disminución de síntomas de síndrome de ovario poliquístico: una revisión narrativa. AMU. 2025;7(1):21-27.
URI: https://hdl.handle.net/10481/105369
