Chanassery Poykkattu, Elena ¹ ²; González de la Parte, Esther ³ ⁴ *
¹ Facultad de Medicina, Universidad de Valladolid
² Academia de Alumnos Internos, Departamento de Osteología y Anatomía Comparada
³ Escuela de Doctorado, Universidad de Valladolid
⁴ Instituto de Oftalmobiología Aplicada (IOBA), Universidad de Valladolid
* Autor de correspondencia: esthergdelaparte@gmail.com
Resumen
La resistencia a los antibióticos representa en la actualidad una crisis sanitaria que causa millones de muertes al año. Esta problemática se debe principalmente al uso inadecuado y excesivo de antibióticos, que ha contribuido durante los últimos años a que las bacterias desarrollen mecanismos de resistencia. Estas características han provocado la pérdida de efectividad de múltiples tratamientos utilizados hasta la fecha, siendo las fluoroquinolonas el ejemplo más representativo en el caso del tratamiento de la queratitis bacteriana. Esta problemática ha generado la necesidad de desarrollar alternativas terapéuticas y de diagnóstico que permitan afrontar el tratamiento de infecciones debido a cepas de bacterias multirresistentes. Por ello, el artículo se centra en el análisis de los perfiles de resistencia que presentan algunas de las bacterias más comunes en la etiología de la queratitis. Esta patología corneal causa al año que miles de pacientes sufran complicaciones graves, siendo de hecho una de las principales causas de ceguera corneal. En este artículo hemos examinado las características de tres bacterias patógenas: Staphylococcus aureus, Pseudomonas aeruginosa, Streptococcus pneumoniae, y una bacteria oportunista: Corynebacterium. Además, hemos revisado los diferentes tratamientos actualmente en uso, así como aquellos que han quedado obsoletos debido a la pérdida de eficacia asociada a las resistencias bacterianas a los antibióticos. Por último, hemos presentado nuevos enfoques terapéuticos con resultados prometedores en estudios preclínicos para cada una de las especies bacterianas comentadas anteriormente. Sin embargo, debe tenerse en cuenta las características de estos estudios, por lo que aún debe validarse su aplicabilidad real en la clínica.
Palabras clave: Queratitis bacteriana, resistencia a antibióticos, Staphylococcus aureus, Pseudomonas aeruginosa, Streptococcus pneumoniae, Corynebacterium.
Abstract
Antibiotic resistance currently represents a global health crisis, accounting for millions of deaths each year. This growing challenge is caused by the inappropriate and excessive use of antibiotics, which has contributed significantly to the development of bacterial resistance mechanisms in recent years. These characteristics have led to a progressive loss of effectiveness in many previously reliable treatments; fluoroquinolones are the most representative example when it comes to the treatment of bacterial keratitis. This growing challenge has caused the urgent need to develop alternative therapies and methods of diagnosis, enabling a better approach to the treatment of infections due to multidrug-resistant bacterial strains. Therefore, this article focuses on the analysis of resistance profiles of the most common bacteria responsible for the etiology of keratitis. This corneal pathology leads to thousands of patients to suffer severe complications, being, in fact, one of the main causes of corneal blindness. In this article, we have examined the features of three pathogenic bacteria: Staphylococcus aureus, Pseudomonas aeruginosa, and Streptococcus pneumoniae; as well as an opportunistic bacteria: Corynebacterium. In addition, we have reviewed the different treatments that are currently used, as well as those that have become obsolete due to loss of efficacy associated with antibiotic resistance. Finally, we have presented novel therapeutic approaches that have shown promising results in preclinical studies for each bacterial species that have been previously mentioned. However, we must take into account the fact that most of the studies are in the preclinical phase; thus, it requires further investigation to determine their clinical applicability.
Keywords: Bacterial keratitis, antibiotic resistance, Staphylococcus aureus, Pseudomonas aeruginosa, Streptococcus pneumoniae, Corynebacterium.
Figura 1. Avances terapéuticos en el abordaje de la queratitis bacteriana multirresistente: una revisión narrativa. Creado con Biorender.
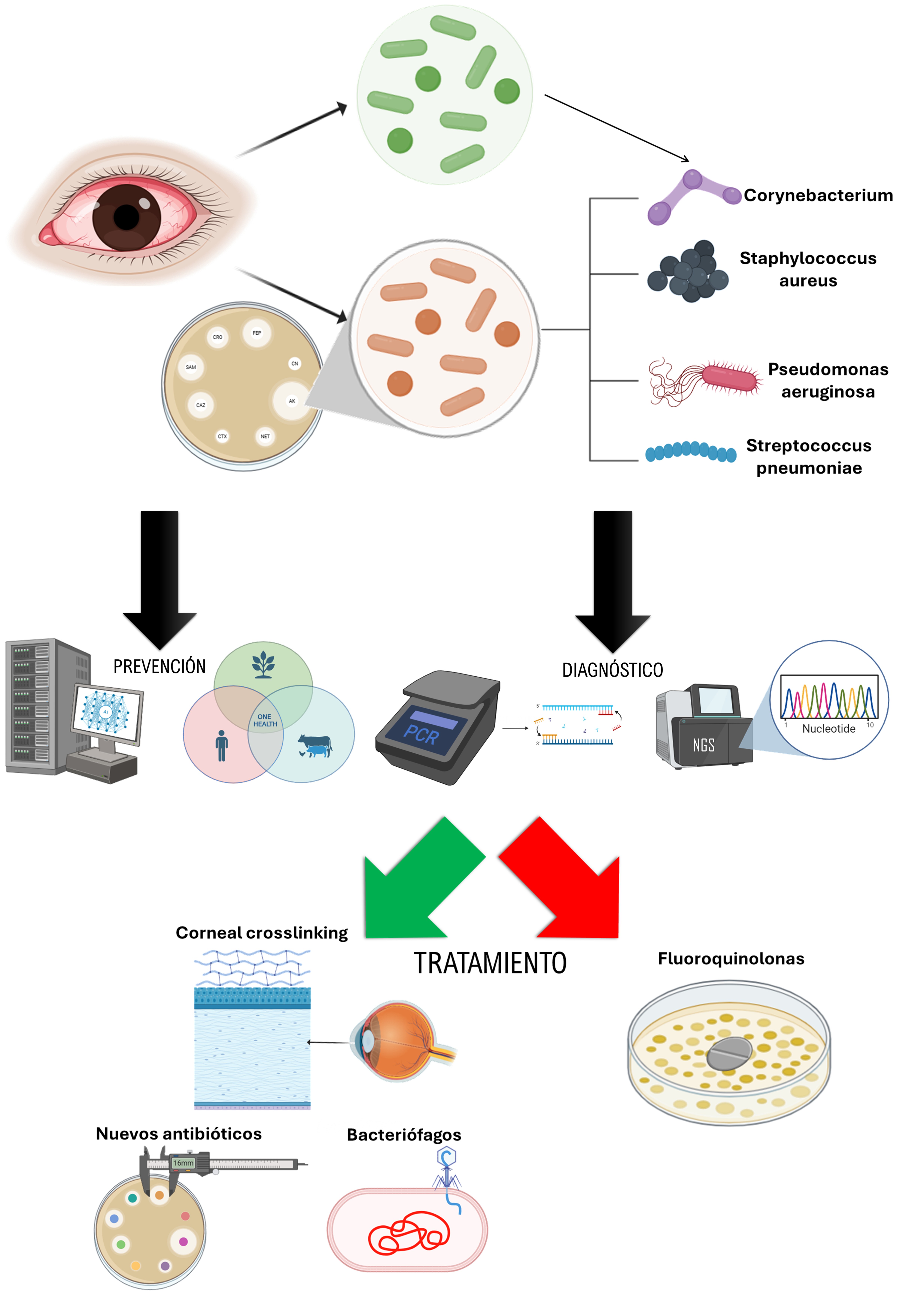
1. Introducción
La superficie ocular es una unidad anatómica que se encuentra en contacto directo con el entorno, por lo que está constantemente expuesta a patógenos externos (1). Diversos estudios han demostrado la existencia de un microbioma fisiológico en la superficie ocular cuya desregulación puede contribuir al desarrollo de diversas patologías, tal y como se presenta en la Tabla 1 (1,2). Normalmente, las infecciones corneales son polimicrobianas como consecuencia de la gran diversidad microbiana en la superficie ocular (1). Sin embargo, el diagnóstico pocos años atrás se basaba en determinar la bacteria predominante en dicha infección, utilizando técnicas con una sensibilidad de apenas el 40% y que no tenían en cuenta la presencia de otros agentes infecciosos (1,2). Durante este proceso, se administraban antibióticos de amplio espectro, que con los años han favorecido el desarrollo de cepas bacterianas resistentes a algunos tratamientos (1,2).
Tabla 1. Ejemplos de bacterias frecuentemente identificadas en la superficie ocular.
| BACTERIA / GÉNERO | ROL | IMPLICACIONES CLÍNICAS | CITA |
| Staphylococcus sp. |
S. epidermidis: C S. aureus: P |
Blefaritis, queratitis, conjuntivitis, celulitis |
Zhu et al., 2024 Yadalla et al., 2023 Okonkwo et al., 2020 |
| Corynebacterium sp. | Comensal muy predominante | Estimula IL-17, defensa frente a patógenos |
Okonkwo et al., 2020 Soni et al., 2022 |
| Propionibacterium sp. | Comensal | Asociado a blefaritis, equilibrio microbiano |
Yadalla et al., 2023 Okonkwo et al., 2020 |
| Streptococcus sp. | Comensal / Patógeno según especie | Puede causar queratitis, endoftalmitis, uveítis |
Yadalla et al., 2023 Okonkwo et al., 2020 |
| Pseudomonas sp. | Patógeno oportunista | Queratitis severa secundaria a lentes de contacto |
Gitter et al., 2024 Wu et al., 2015 |
| Acinetobacter sp. | Patógeno oportunista | Queratitis, infecciones nosocomiales |
Graham et al., 2007 Okonkwo et al., 2020 |
| Serratia sp. | Patógeno oportunista | Implicado en queratitis |
Wu et al., 2015 Venkatesh et al., 2017 |
C: Comensal, P: Patógeno
La resistencia a los antimicrobianos (RAM) se define como la ausencia de respuesta de microorganismos frente fármacos empleados hasta el momento para tratarlos (3). Las especies con esta característica poseen una mayor capacidad de propagación de infecciones graves y difíciles de tratar. Esto supone un problema sanitario que amenaza la salud mundial, siendo la causa de aproximadamente 1,27 millones de muertes al año. De hecho, se estima que dicha cifra ascienda hasta los 10 millones en 2050 en caso de no implantar medidas preventivas eficaces (3). En el caso de algunas enfermedades oculares como la queratitis, las bacterias multirresistentes han aumentado su incidencia, con una frecuencia que varía entre 40 y 100 casos por cada 100.000 personas al año, dependiendo del área geográfica, en Europa e India, respectivamente (1,4). Además, la prevalencia aumenta en personas cuya integridad del epitelio corneal se encuentra comprometida debido a quemaduras químicas, traumatismos, mal uso de lentes de contacto, enfermedades congénitas o inmunodeficiencia (1,5). En ellos, la queratitis causa inflamación, úlceras, neovascularización y cicatrices corneales que comprometen la transparencia corneal. En casos más graves, especialmente cuando aparecen bacterias multirresistentes, existe el riesgo de tener que someterse a un procedimiento de enucleación ocular (1,6).
La RAM se atribuye principalmente al uso inadecuado y abusivo de antibióticos en la clínica. Por otra parte, la globalización y el empleo de antimicrobianos en ganadería, agricultura e industria también han contribuido al aumento de esta problemática (7). Por ello, la RAM constituye un desafío que afecta a múltiples ámbitos y que conlleva un riesgo serio especialmente en niños, adultos mayores y pacientes inmunocomprometidos (8). El riesgo asociado a la RAM podría reducirse si los fármacos se utilizaran con fines terapéuticos o para profilaxis en casos puntuales, pero nunca como factores de crecimiento (9). Frente a la amenaza que suponen las bacterias multirresistentes, en los últimos años se han desarrollado técnicas diagnósticas avanzadas y sensibles basadas en biología molecular, como la Reacción en Cadena de la Polimerasa y la Secuenciación de Nueva Generación (PCR y NGS por sus siglas en inglés, respectivamente) (1,2). Por otro lado, se han desarrollado tratamientos como bacteriófagos, con resultados prometedores hasta la fecha. Asimismo, la coadministración de antibióticos y otros compuestos representan una estrategia útil para limitar la aparición de cepas multirresistentes (10). Recientemente, han surgido alternativas interdisciplinarias como la Inteligencia Artificial para la predicción de resistencias o el sistema One Health, cuyas características se presentan en la Tabla 2 (8,9). En conjunto, estas nuevas estrategias pueden abrir una vía de tratamiento que disminuya las graves consecuencias derivadas de sufrir una infección por bacterias multirresistentes.
Tabla 2. Descripción de la muestra
| 1 | Llevar a cabo campañas de concienciación globalmente para educar a la sociedad sobre las repercusiones resultantes del abuso y uso inadecuado de los antibióticos. |
| 2 | Reforzar las medidas higiénicas y prevenir la propagación de infecciones, con lo que disminuirá la demanda del uso de antibióticos y con ello la posible aparición de cepas resistentes. |
| 3 | Minimizar el uso de antibióticos prescindibles en agricultura y su diseminación en el medio ambiente. |
| 4 | Potenciar la supervisión global de RAM. Se debe fomentar una mejor comprensión de temas como el consumo de antibióticos en seres humanos y animales, las tasas de resistencia antibiótica actuales y las bases moleculares de la RAM. |
| 5 | Fomentar nuevas técnicas de diagnóstico que sean veloces y precisas. Así se evitan diagnósticos erróneos y la prescripción incorrecta de antibióticos. |
| 6 | Promover el desarrollo de vacunas y otras potenciales alternativas. |
| 7 | Otorgar reconocimiento institucional e incrementar el número de profesionales que trabajan con enfermedades infecciosas. Profesionales como microbiólogos, farmacéuticos, veterinarios, enfermeros, epidemiólogos… |
| 8 | Priorizar la inversión en el ámbito de la investigación para el desarrollo de nuevos tratamientos. |
| 9 | Establecer mejores incentivos para promover dicha inversión en nuevos fármacos y la optimización de los ya existentes. A las empresas farmacéuticas no les interesa el desarrollo de nuevos fármacos porque ya existen ciertos fármacos que siguen siendo eficaces y además tienen que hacer frente al riesgo de su posible ineficacia debido a la incertidumbre que generan los mecanismos de la RAM. |
| 10 | Crear una coalición internacional para combatir la RAM. |
2. Objetivos
Este artículo se centra en revisar la evidencia científica actual acerca de la RAM y sus implicaciones en el tratamiento de la queratitis corneal dependiendo de la bacteria causante de la patología. Además, se describe la epidemiología, fisiopatología y consecuencias de la queratitis, así como las terapias utilizadas en la práctica clínica habitual y la problemática derivada de la RAM. Finalmente, se evaluarán los tratamientos más efectivos para la queratitis bacteriana en pacientes con infecciones refractarias al tratamiento con los antibióticos de uso común.
3. Resultados
3.1. Queratitis microbiana por Pseudomona aeruginosa
Pseudomonas aeruginosa es el bacilo oportunista Gram negativo más frecuentemente implicado en la queratitis microbiana a nivel mundial (6,11). Aunque la incidencia de la enfermedad por esta causa ha disminuido en los últimos años, todavía se le atribuyen en torno al 68% de los casos (6,11). Existen factores de riesgo que aumentan la probabilidad de sufrir una infección por esta bacteria, destacando el mal uso de lentes de contacto (11). P. aeruginosa presenta resistencia intrínseca a diversos antibióticos como carbapenémicos y aminoglucósidos (6,11), efecto que puede aumentar mediante la acepción de plásmidos, transposones e integrones. Por ello, se estima que entre el 40% y el 52% de las cepas son resistentes al menos a un antibiótico (11,12).
Durante años, el tratamiento convencional de las infecciones por P. aeruginosa fueron las fluoroquinolonas. Sin embargo, la concentración mínima inhibitoria en la actualidad puede ser hasta 32 veces mayor que para otros patógenos. Este efecto ha llevado a la OMS a considerar la P. aeruginosa como uno de los tres patógenos en prioridad 1 para buscar nuevos tratamientos (6). En la actualidad, los antibióticos frente a los que P. aeruginosa presenta menos resistencia son la tobramicina (13) y el levofloxacino (6), aunque existen otras opciones como amikacina (11), penicilinas o carbapenémicos (6). Como técnica complementaria existe el lavado subpalpebral con antibióticos, que, aunque poco extendida, permite irrigar el ojo con antibióticos a elevada concentración, mejorando la eficacia terapéutica (14).
En los últimos años se han desarrollado nuevos tratamientos contra cepas resistentes de P. aeruginosa, como antibióticos tópicos combinados (5,11). Por otro lado, se han probado terapias alternativas frente a cepas que expresan la toxina exoU o algunos genes como blaVIM y blaGES. Frente a estos mecanismos de resistencia, la terapia fotodinámica antimicrobiana con rosa de bengala actúa como adyuvante de antibióticos. Esta terapia ha demostrado tener una eficacia de entre el 89-99% in vitro y en ensayos clínicos en pacientes (15,16). De forma similar, se ha utilizado el cross-linking corneal activado por radiación UV, que ha demostrado ser efectivo tanto en estudios in vivo como en pacientes, en los que mejora la reepitelización y disminuye la infiltración bacteriana al tejido corneal (17,18). También se han estudiado nuevas moléculas como la genipina, que ha demostrado ser capaz de reducir la carga bacteriana, la infiltración de neutrófilos en la córnea y la expresión de citoquinas proinflamatorias en un modelo in vivo. De hecho, este fármaco mejora la resistencia frente a infecciones por P. aeruginosa y S. aureus (19). Sin embargo, los tratamientos en desarrollo que parecen tener mayor potencial son los bacteriófagos y el plasma frío, ya que preservan la estructura corneal y disminuyen los signos clínicos al favorecer la rotura de biofilms (20). En concreto, el plasma frío es capaz de inhibir el crecimiento bacteriano en menos de 5 minutos (21). Por otro lado, se han desarrollado vacunas basadas en péptidos miméticos, anticuerpos monoclonales o con compuestos líticos producidos por los pacientes, con resultados prometedores hasta la fecha (5).
3.2. Queratitis microbiana por Staphylococcus aureus
Staphylococcus aureus es una bacteria Gram positiva presente en piel y mucosas que puede invadir la córnea o lentes de contacto, provocando infecciones (22). Para combatir la infección, el tejido corneal secreta moléculas bactericidas como la proteína surfactante D (SP-D). Sin embargo, S. aureus genera un biofilm que dificulta la administración de antibióticos, lo que puede acabar generando RAM (23). De hecho, S. aureus es la bacteria Gram positiva más común en la queratitis, con una incidencia creciente de algunas cepas como la resistente a meticilina, que ronda el 35% en algunas áreas geográficas (23), provocando 2 millones de casos de ceguera al año (5).
A lo largo de los años, la queratitis por S. aureus se ha tratado de diversas formas. Para disminuir la inflamación se han utilizado corticosteroides, pero la evidencia de su efectividad es limitada (23). Las fluoroquinolonas como el ciprofloxacino y levofloxacino han sido el grupo de antibióticos más común en oftalmología a lo largo de los años (24). Sin embargo, las nuevas cepas presentan una resistencia de hasta el 80% (23). Por ello, la opción más aceptada en la actualidad son la vancomicina y el linezolid, que presentan poca resistencia, pero generan alta toxicidad (23). Para hacer frente a esta problemática, en los últimos años se han desarrollado nuevos tratamientos frente a cepas multirresistentes. Los inhibidores de proteasas como Staphostatina y los anticuerpos frente a Staphopain, han sido útiles para mejorar la permanencia de la SP-D y para dificultar la formación del biofilm. Esta capacidad también puede abordarse mediante terapias génicas (23,25). Sin embargo, uno de los tratamientos más efectivos en la actualidad es el uso combinado de antibióticos como tetraciclina/gentamicina (23), o combinaciones de cefazolina y/o tobramicina (26).
Por otro lado, es necesario optimizar la estrategia de administración. Se ha probado a inyectar los medicamentos de forma intra estromal (27) o utilizando hidrogeles cargados con sulfato para inducir ferroptosis bacteriana (28). En este ámbito existen estudios que han explorado el uso de liposomas, nanopartículas e imprinting molecular como herramientas para mejorar la capacidad de penetración de los antibióticos a través de biofilms (23). Todos estos métodos son especialmente interesantes en el caso de infecciones corneales profundas, ya que facilitan la acción de los fármacos antes de que las bacterias puedan desarrollar resistencia al tratamiento. Sin embargo, aún deben seguir siendo estudiadas para conocer la tasa de eficacia real, ya que no existe aún un consenso claro sobre estos datos (27,28). Por otro lado, también se debe profundizar en el estudio de la efectividad de otras terapias comentadas en el apartado anterior como el crosslinking corneal, el uso de plasma o fagos bacterianos, con resultados prometedores hasta la fecha (29).
3.3. Queratitis microbiana por Streptococcus pneumoniae
Streptococcus pneumoniae es una bacteria Gram positiva implicada frecuentemente en la queratitis secundaria a traumatismos oculares. S. pneumoniae es un patógeno ubicuo, con una prevalencia que varía en función del área geográfica (30), desde el 3% en Reino Unido hasta entre 7,2% y 11,6% en India (31). Esta especie expresa adhesinas que se unen con alta afinidad a la matriz extracelular, facilitando su internalización en células epiteliales. Además, presenta diversos factores de virulencia que dañan otras estructuras de la superficie ocular como la pneumolisina (PLY), que provoca necrosis licuefactiva en una proporción significativa de úlceras (31,32).
El tratamiento actual para las enfermedades oculares originadas por S. pneumoniae consiste en intervenciones quirúrgicas y uso de diversos antibióticos como las fluoroquinolonas tópicas. Además, es común el uso de terapias con penicilina G o ceftriaxona para cepas refractarias a la penicilina (30). No obstante, esta bacteria ha comenzado a desarrollar resistencia a algunos de estos tratamientos (33).
Para hacer frente a este problema, se han desarrollado fluoroquinolonas de nueva generación como avarofloxacina, que tiene un valor de MIC90 de 0,25 mg/L y la zabofloxacina, que tiene un valor de MIC90 de 0,03 mg/L. Estos valores tan bajos son indicativos de su buena potencia y eficacia clínica. (34). Además, se han probado combinaciones antibióticas con resultados prometedores como fluoroquinolona/rifamicina, con el que el 78-96% de las cepas de un estudio eran susceptibles a fluoroquinolonas y el 92% a la rifamicina (31). De forma similar a las otras dos bacterias que ya se han explicado, el uso de terapias alternativas como el crosslinking corneal mediante luz ultravioleta-A/riboflavina está mejorando también el tratamiento de la patología (35). Otra opción son los anticuerpos anti-PLY, que pueden ser muy eficaces en caso de ser administrados junto con antibióticos (36). Por otro lado, existen estudios que señalan el colesterol como un adyuvante para la terapia, mostrando gran utilidad para el tratamiento de queratitis pneumocócica (37). Este tratamiento puede administrarse junto con moxifloxacino para lograr la esterilización de la córnea y disminuir de forma notable la gravedad de la infección (38). Por otro lado, están emergiendo propuestas de tratamiento como la utilización de péptidos antimicrobianos, fármacos antibiofilm, nanopartículas de plata o terapias multimodales, entre otros (30). No obstante, deben de realizarse estudios para comprobar la eficacia de estas estrategias en la queratitis resultante de este patógeno.
3.4. Queratitis microbiana por Corynebacterium species
El género Corynebacterium comprende un conjunto de 137 especies de bacterias Gram positivas inmóviles. Dentro de este grupo, destacan 10 especies aisladas frecuentemente en la superficie ocular, como Corynebacterium macginleyi (la especie más asociada a queratitis), C. xerosis o C. diphteriae, siendo esta última capaz de penetrar el epitelio corneal intacto (39,40). Estas bacterias forman parte de la microbiota del saco conjuntival y los párpados, donde previenen de la invasión de agentes extraños en la superficie ocular. Sin embargo, pueden comportarse como patógenos oportunistas, especialmente en pacientes inmunocomprometidos (39,41). En la actualidad, no suele reportarse la presencia de especies de Corynebacterium aisladas en muestras clínicas dado que son consideradas como contaminantes. No obstante, esta subestimación diagnóstica puede conducir al fracaso terapéutico en algunos casos de queratitis (40).
Corynebacterium sp. mostraron durante muchos años sensibilidad a diversos antibióticos como penicilina, gentamicina o fluoroquinolonas. No obstante, la resistencia de estas bacterias está aumentando, especialmente frente a fluoroquinolonas y macrólidos (39,42). En este género, la RAM suele desarrollarse por mutaciones puntuales en genes que codifican el sitio diana del fármaco, reduciendo la afinidad del antibiótico por su objetivo. Varios estudios han demostrado resistencias de hasta a un 91% de las fluoroquinolonas debido a estas mutaciones (39), destacando bacterias resistentes a levofloxacina, gatifloxacina y moxiflacino. En la actualidad, C. macginleyi es la única especie con una resistencia del 100% frente a este grupo antibiótico (39,41). Sin embargo, también se han reportado casos de resistencia al cloranfenicol (43), lincosamidas y macrólidos (44).
En el caso de especies multirresistentes de Corynebacterium existe el riesgo de no poder tratar las infecciones ni tan siquiera con cefalosporinas de tercera generación como la cefmenoxima (39,41). Se cree que el uso intensificado de antibióticos durante la pandemia del Covid-19 puede haber alterado el equilibrio de la microbiota ocular al suprimir la flora competidora, favoreciendo la formación de biopelículas de Corynebacterium multirresistentes a diversos antibióticos (45). En estos casos, la eliminación física de las bacterias puede ser eficaz como tratamiento (41). Existen otras alternativas con resultados prometedores, como la administración combinada de carbapenémicos sistémico y glucopéptidos, junto con la administración de aminoglucósidos o colirios de ceftazidima (40). No obstante, deben ser valoradas otras alternativas tales como el empleo de vancomicina o el remplazo de las fluoroquinolonas por cefalosporinas de nueva generación (41).
4. Limitaciones
Este trabajo corresponde a una revisión narrativa, por lo que presenta limitaciones asociadas a este tipo de estudio. En primer lugar, puede haber un sesgo en la presentación de tratamientos, así como en sus fortalezas y limitaciones, dado que no se ha seguido una metodología de búsqueda característica de una revisión sistemática. Aunque se revisó una bibliografía más extensa que la finalmente plasmada en el trabajo, pueden haberse omitido estudios relevantes. Para disminuir esta limitación, se realizaron búsquedas en PubMed (siempre que fue posible) limitando los resultados a los últimos 10 años y utilizando las opciones de búsqueda avanzada con la estructura: “bacterial keratitis” AND “treatment” OR “epidemiology” AND “especie bacteriana”. Otra limitación de este trabajo es debida a la heterogeneidad de los resultados según la región geográfica. Se sabe que la epidemiología y la respuesta al tratamiento pueden variar en función de la cepa bacteriana predominante en cada país, lo que limita la generalización de los tratamientos de forma global. Para abordar esta variabilidad, se procuró incluir información representativa de distintas zonas del mundo.
5. Conclusiones
La RAM es una amenaza para la salud mundial que supone un problema crítico y creciente en el diagnóstico y tratamiento de diversas patologías. En el campo de la oftalmología, la queratitis bacteriana debida a bacterias multirresistentes se debe a causas tales como la desregulación del microbioma de la superficie ocular o el uso indiscriminado de antibióticos de amplio espectro. En consecuencia, la queratitis bacteriana ha demostrado tener consecuencias graves tales como úlceras corneales o incluso la enucleación ocular en casos graves.
La epidemiología de la queratitis varía según la región geográfica y el agente etiológico. Las bacterias más frecuentemente implicadas —Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae y Corynebacterium— muestran distintas prevalencias e impactos, pese a que existen factores de riesgo comunes tales como el mal uso de lentes de contacto, los traumatismos oculares o la inmunosupresión.
Sin embargo, la fisiopatología de cada bacteria es diferente:
- P. aeruginosa es una bacteria que presenta múltiples mecanismos de resistencia genética, y que tiene una capacidad de penetrancia corneal muy rápida.
- S. aureus se caracteriza principalmente por la formación de biopelículas que dificultan la acción antibiótica.
- S. pneumoniae produce toxinas que inducen necrosis corneal.
- Corynebacterium es una especie oportunista que puede pasar desapercibida clínicamente, pero que puede provocar casos graves de queratitis debido a cepas multirresistentes y altamente invasivas.
Las terapias convencionales son cada vez menos efectivas frente a cepas multirresistentes. Las fluoroquinolonas fueron el tratamiento de elección hasta hace pocos años, pero en la actualidad muestran resistencias superiores al 80% en algunas especies. Aunque antibióticos como vancomicina, linezolid, cefazolina o tobramicina aún se utilizan, su toxicidad o eficacia limitada impulsa el desarrollo de nuevas estrategias.
Para hacer frente a esta problemática, se han identificado tratamientos que eluden los mecanismos de resistencia bacteriana y que han presentado resultados prometedores en fases preclínicas, como:
- Terapias físicas (plasma frío, crosslinking corneal con UVA/riboflavina).
- Nanotecnología (liposomas, nanopartículas, hidrogeles).
- Bacteriófagos y vacunas experimentales.
- Combinaciones antibióticas específicas adaptadas a la bacteria y su perfil de resistencia.
Aunque la RAM representa un serio desafío para la salud global, los avances tecnológicos y terapéuticos actuales abren una vía de esperanza que permiten enfrentar infecciones previamente intratables y mejoran la calidad y esperanza de vida para los pacientes afectados.
Declaraciones
Agradecimientos
A la Facultad de Medicina de la Universidad de Valladolid por ofrecer el curso “Introducción a la metodología y estrategias para la publicación de artículos en Biomedicina”. En especial a nuestro tutor Pablo Redruello Guerrero por habernos transmitido su pasión por la investigación, así como sus valiosos consejos para la realización de este artículo.
Contribución de los autores
Ambas autoras contribuyeron por igual a este trabajo.
Conflictos de interés
Las autoras declaran no tener conflictos de interés.
Financiación
Ninguna.
Referencias
- Tuft S, Somerville TF, Li JPO, Neal T, De S, Horsburgh MJ, et al. Bacterial keratitis: identifying the areas of clinical uncertainty. Prog Retin Eye Res. 2022;89:101031.
- Graham JE, Moore JE, Jiru X, Moore JE, Goodall EA, Dooley JSG, et al. Ocular Pathogen or Commensal: A PCR-Based Study of Surface Bacterial Flora in Normal and Dry Eyes. Invest Ophthalmol Vis Sci. 2007;48(12):5616–23.
- Tang KWK, Millar BC, Moore JE. Antimicrobial Resistance (AMR). Br J Biomed Sci. 2023;80:11387.
- Lamas-Francis D, Navarro D, Mansilla R, de-Rojas V, Moreno C, Dios E, et al. Microbial keratitis in north-western Spain: a review of risk factors, microbiological profile and resistance patterns. Eur J Clin Microbiol Infect Dis. 2024;44(1):53–61.
- Shah S, Wozniak RAF. Staphylococcus aureus and Pseudomonas aeruginosa infectious keratitis: key bacterial mechanisms that mediate pathogenesis and emerging therapeutics. Front Cell Infect Microbiol. 2023;13:1250257.
- Khor WB, Lakshminarayanan R, Periayah MH, Prajna VN, Garg P, Sharma N, et al. The antibiotic resistance profiles of Pseudomonas aeruginosa in the Asia Cornea Society Infectious Keratitis Study. Int Ophthalmol. 2024;44(1):1–10.
- Uddin TM, Chakraborty AJ, Khusro A, Zidan BRM, Mitra S, Emran T Bin, et al. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021;14(12):1750–66.
- Ho CS, Wong CTH, Aung TT, Lakshminarayanan R, Mehta JS, Rauz S, et al. Antimicrobial resistance: a concise update. Lancet Microbe. 2024;6(1):100947.
- Velazquez-Meza ME, Galarde-López M, Carrillo-Quiróz B, Alpuche-Aranda CM. Antimicrobial resistance: One Health approach. Vet World. 2022;15(3):743.
- Xiao G, Li J, Sun Z. The Combination of Antibiotic and Non-Antibiotic Compounds Improves Antibiotic Efficacy against Multidrug-Resistant Bacteria. Int J Mol Sci. 2023;24(20):15493.
- Subedi D, Vijay AK, Willcox M. Overview of mechanisms of antibiotic resistance in Pseudomonas aeruginosa: an ocular perspective. Clin Exp Optom. 2018;101(2):162–71.
- Itoi M, Willcox MDP. Comparison of susceptibility of Pseudomonas aeruginosa isolated from keratitis to antibiotics and multipurpose disinfecting solutions. Cont Lens Anterior Eye. 2024;47(6):102288.
- Nguyen PH, Nguyen MTT, Nguyen XTT, Ngo TT, Vu TVT, Duong TV, et al. Characteristics of Pseudomonas aeruginosa keratitis at Ho Chi Minh eye hospital. Int Ophthalmol. 2025;45(1):1–12.
- Yang LY, Huang JJM, Toohey TP, Wong ELS, Khan MA, Jiang IW, et al. Subpalpebral Antibiotic Lavage as Safe, Emergent, and Cost-Effective Management of Acute Infectious Keratitis Related to Contact Lens Overwear: Case Report and Literature Review. Cornea. 2022;41(2):249–51.
- Tribin FE, Lieux C, Maestre-Mesa J, Durkee H, Krishna K, Chou B, et al. Clinical Features and Treatment Outcomes of Carbapenem-Resistant Pseudomonas aeruginosa Keratitis. JAMA Ophthalmol. 2024;142(5):407.
- Durkee H, Arboleda A, Aguilar MC, Martinez JD, Alawa KA, Relhan N, et al. Rose bengal photodynamic antimicrobial therapy to inhibit Pseudomonas aeruginosa keratitis isolates. Lasers Med Sci. 2020;35(4):861–6.
- Khalili MR, Jahadi HR, Karimiarimi M, Yasemi M. Corneal collagen cross-linking for treatment of bacterial and herpetic keratitis. Journal of Clinical and Diagnostic Research. 2017;11(7):NC12–6.
- Marrie A, Abdullatif AM, Gamal El Dine S, Yehia R, Saied R, Tolba DA. Corneal cross-linking guards against infectious keratitis: an experimental model. Int Ophthalmol. 2023;43(4):1241–8.
- Huertas-Bello M, Cuéllar-Sáenz JA, Rodriguez CN, Cortés-Vecino JA, Navarrete ML, Avila MY, et al. A Pilot Study to Evaluate Genipin in Staphylococcus aureus and Pseudomonas aeruginosa Keratitis Models: Modulation of Pro-Inflammatory Cytokines and Matrix Metalloproteinases. Int J Mol Sci. 2023;24(8):6904.
- Chen L, Wu MY, Chen SL, Hu R, Wang Y, Zeng W, et al. The Guardian of Vision: Intelligent Bacteriophage-Based Eyedrops for Clinical Multidrug-Resistant Ocular Surface Infections. Advanced Materials. 2024;36(38).
- Marx AH, Oltmanns H, Meißner J, Verspohl J, Fuchsluger T, Busse C. Argon cold atmospheric plasma eradicates pathogens in vitro that are commonly associated with canine bacterial keratitis. Front Vet Sci. 2024;10:1320145.
- Chen Y, Song Y, Wang Z, Lai Y, Yin W, Cai Q, et al. The chemerin-CMKLR1 axis in keratinocytes impairs innate host defense against cutaneous Staphylococcus aureus infection. Cell Mol Immunol. 2024;21(6):533–45.
- Lee JW, Somerville T, Kaye SB, Romano V. Staphylococcus aureus Keratitis: Incidence, Pathophysiology, Risk Factors and Novel Strategies for Treatment. J Clin Med. 2021;10(4):758.
- Zhou R, Wang Q, Yuan L, Zhou H, Xue J. Safety and efficacy of fortified antibiotics and fluoroquinolones for the treatment of bacterial keratitis: A meta-analysis. J Fr Ophtalmol. 2024;47(5).
- Afzal M, Vijay AK, Stapleton F, Willcox M. Virulence Genes of Staphylococcus aureus Associated With Keratitis, Conjunctivitis, and Contact Lens–Associated Inflammation. Transl Vis Sci Technol. 2022;11(7):5–5.
- Schmidt-Hellerau K, Breuninger M, Kessel J, Vehreschild MJGT, Paul G, Reusch J, et al. Flucloxacillin and cefazolin for treatment of Staphylococcus aureus bloodstream infection. Infection. 2024;52(3):1159–63.
- Pak CM, Savage DE, Plotnik R, Wozniak RAF. Intrastromal Antibiotic Injection in Polymicrobial Keratitis: Case Report and Literature Review. Case Rep Ophthalmol. 2022;13(2):550–5.
- Wang Z, Li H, Zhou W, Lee J, Liu Z, An Z, et al. Ferrous sulfate-loaded hydrogel cures Staphylococcus aureus infection via facilitating a ferroptosis-like bacterial cell death in a mouse keratitis model. Biomaterials. 2022;290:121842.
- Patil R, Dehari D, Chaudhuri A, Kumar DN, Kumar D, Singh S, et al. Recent advancements in nanotechnology-based bacteriophage delivery strategies against bacterial ocular infections. Microbiol Res. 2023;273:127413.
- Yu M, Li L, Liu Y, Wang T, Li H, Shi C, et al. Pathogenesis and Treatment Strategies for Infectious Keratitis: Exploring Antibiotics, Antimicrobial Peptides, Nanotechnology, and Emerging Therapies. J Pharm Anal. 2025;101250.
- Garcin T, Hoarau G, Leger V, Merabet L, Brignole-Baudouin F, Borderie V, et al. Streptococcus pneumoniae keratitis: epidemiology and outcomes over 6 years in a French eye care center. Eur J Clin Microbiol Infect Dis. 2025;44(4):963–72.
- Nanayakkara U, Khan MA, Hargun DK, Sivagnanam S, Samarawickrama C. Ocular streptococcal infections: A clinical and microbiological review. Surv Ophthalmol. 2023;68(4):678–96.
- Cheng Z, Shi Q, Peng B, Zhang Z, Wei Z, Wang Z, et al. Risk Factors, Clinical Characteristics, and Antibiotic Susceptibility Patterns of Streptococcal Keratitis: An 18-Year Retrospective Study from a Tertiary Hospital in China. Antibiotics. 2024;13(12):1190.
- Herbert R, Caddick M, Somerville T, McLean K, Herwitker S, Neal T, et al. Potential new fluoroquinolone treatments for suspected bacterial keratitis. BMJ Open Ophthalmol. 2022;7(1):e001002.
- Oflaz AB, Bozkurt B, Kamış Ü, Köktekir BE. Corneal Collagen Crosslinking Treatment in a Case with Pneumococcal Keratitis. Turk J Ophthalmol. 2017;47(3):161.
- Green SN, Sanders M, Moore QC, Norcross EW, Monds KS, Caballero AR, et al. Protection from Streptococcus pneumoniae Keratitis by Passive Immunization with Pneumolysin Antiserum. Invest Ophthalmol Vis Sci. 2008;49(1):290.
- Marquart ME, Monds KS, McCormick CC, Dixon SN, Sanders ME, Reed JM, et al. Cholesterol as Treatment for Pneumococcal Keratitis: Cholesterol-Specific Inhibition of Pneumolysin in the Cornea. Invest Ophthalmol Vis Sci. 2007;48(6):2661.
- Sanders ME, Tullos NA, Taylor SD, Norcross EW, King LB, Tolo I, et al. Moxifloxacin and Cholesterol Combined Treatment of Pneumococcal Keratitis. Curr Eye Res. 2010;35(12):1142.
- Aoki T, Kitazawa K, Deguchi H, Sotozono C. Current Evidence for Corynebacterium on the Ocular Surface. Microorganisms. 2021;9(2):254.
- Eguchi H. Ocular Infections Caused by Corynebacterium Species. Infection Control. InTech; 2013
- Inoue H, Toriyama K, Murakami S, Miyamoto H, Ikegawa W, Takezawa Y, et al. Clinical and bacteriological characteristics of Corynebacterium keratitis. J Ophthalmic Inflamm Infect. 2025;15(1):2.
- Satija G, Dave A, Gandhi A, Acharya M, Khanna D. Severe Corynebacterium Keratitis Successfully Managed Medically: A Case Report and Review of Literature. JOJ Ophthalmol. 2023;10(2):1–3.
- Cabrera-Aguas M, Khoo P, George CRR, Lahra MM, Watson SL. Antimicrobial resistance trends in bacterial keratitis over 5 years in Sydney, Australia. Clin Exp Ophthalmol. 2020;48(2):183–91.
- Tresch M, Watté C, Stengard M, Ritter C, Brodard I, Feyer S, et al. Corynebacterium oculi-related bacterium may act as a pathogen and carrier of antimicrobial resistance genes in dogs: a case report. BMC Vet Res. 2023;19(1):251.
- Shi Q, Mao D, Zhang Z, Qudsi AI, Wei M, Cheng Z, et al. Epidemiological and Antimicrobial Resistance Trends in Bacterial Keratitis: A Hospital-Based 10-Year Study (2014–2024). Microorganisms. 2025;13(3):670.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 19/02/2025
Fecha de revisión: 01/03/2025
Fecha de aceptación: 18/04/2025
Cita el artículo: Chanassery Poykkattu E, González de la Parte E. Avances terapéuticos en el abordaje de la queratitis bacteriana multirresistente: una revisión narrativa. AMU. 2025;7(1):36-44.
URI: https://hdl.handle.net/10481/105371
