Caravaca-Cabo, Patricia¹ ²; Cepero-Alcántara, Guillermo¹ ² *; Portillo-Medina, Carla¹ ²; Gómez-Valero, Óscar¹ ²; Nasi-García, Luca¹ ²
¹ Universidad de Granada (UGR)
² Academia de Alumnos Internos Facultad de Medicina UGR
* Autor de correspondencia: guillermocasardia@gmail.com
Resumen
La enfermedad de Alzheimer (EA) es el trastorno neurodegenerativo asociado a la demencia más frecuente en pacientes de edad avanzada. La EA se caracteriza por el depósito extracelular de fibrillas de β-amiloide (Aβ) y la formación de ovillos de proteínas Tau hiperfosforiladas en el citoplasma de las neuronas. Estos mecanismos tienen un efecto neurotóxico causante de la degeneración del SNC. A lo largo de la historia, los tratamientos convencionales la EA se han centrado en paliar los síntomas de la enfermedad. Entre ellos destacamos los Inhibidores de la Acetil Colinesterasa (IAChE) y bloqueadores del Ácido N-meti-D-Aspártico (antagonistas de NMDA), o incluso terapias no farmacológicas centradas en el ejercicio, la interacción social o la música, entre otros. No obstante, se está investigando la posibilidad de crear un fármaco que verdaderamente cure la enfermedad. El uso de anticuerpos monoclonales (AcMo) como tratamiento para la EA ha supuesto un nuevo paradigma, abriendo una prometedora línea de investigación. Estos AcMo se unen a las proteínas patogénicas de la EA para su eliminación por parte del sistema inmune. Algunos AcMo, como el lecanemab, han tenido éxito en la lucha contra la demencia relacionada con la EA. Sin embargo, la EA sigue careciendo de una estrategia de tratamiento eficaz para el control de los síntomas, no existiendo una cura definitiva de la enfermedad. La alta prevalencia de efectos secundarios consecuencia de los AcMo, ha supuesto controversia a la hora de comercializarlos, aunque no sean graves en su mayoría. Los más comunes son las anomalías de imagen relacionadas con los amiloides (ARIA), en forma de edemas (ARIA-E) o microhemorragias (ARIA-H), causadas principalmente por la reacción inflamatoria. Se concluye que resulta conveniente la combinación de distintas terapias para retrasar la progresión de la EA. Sin embargo, se necesita más investigación para desvelar los efectos de los AcMo a largo plazo y para el desarrollo de nuevos tratamientos dirigidos que puedan tratar la EA y sus síntomas con mayor efectividad.
Palabras clave: enfermedad de Alzheimer, anticuerpos monoclonales, anomalías de imagen relacionadas con los amiloides, terapias convencionales.
Abstract
Alzheimer’s disease (AD) is the most common neurodegenerative disorder associated with dementia in elderly patients. AD is characterized by the extracellular deposition of β-amyloid (Aβ) fibrils and the formation of tangles of hyperphosphorylated Tau proteins in the cytoplasm of neurons. These mechanisms have a neurotoxic effect causing CNS degeneration. Throughout history, conventional treatments for AD have focused on alleviating the symptoms of the disease. These include acetyl cholinesterase inhibitors (ChEI) and N-methyl-D-aspartic acid blockers (NMDA antagonists), or even non-pharmacological therapies focused on exercise, social interaction or music, among others. However, the possibility of creating a drug that truly cures the disease is being investigated. The use of monoclonal antibodies (MAB) as a treatment for AD has been a new paradigm, opening a promising line of research. These MABs bind to pathogenic AD proteins for elimination by the immune system. Some MAB, such as lecanemab, have been successful in combating AD-related dementia. However, AD still lacks an effective treatment strategy for symptom control, with no definitive cure for the disease. The high prevalence of side effects resulting from MAB has led to controversy when marketing them, although most of them are not serious. The most common are amyloid-related imaging abnormalities (ARIA), in the form of edema (ARIA-E) or microhemorrhages (ARIA-H) caused mainly by the inflammatory reaction. We conclude that a combination of different therapies is desirable to delay the progression of AD. However, more research is needed to unveil the long-term effects of MAB and for the development of new targeted therapies that can treat AD and its symptoms more effectively.
Keywords: Alzheimer’s disease, monoclonal antibodies, amyloid-related imaging abnormalities, conventional therapies.
1. Introducción
Los trastornos neurodegenerativos asociados a la demencia son una de las causas más frecuentes de mortalidad en España, llegando a representar más del 8% de las defunciones en nuestro país (1). Además, la demencia es uno de los principales motivos de dependencia y discapacidad, disminuyendo radicalmente la calidad de vida del paciente y de sus familiares, que deben cuidar de él (2). La Enfermedad de Alzheimer (EA), causa entre el 50 y el 70% de los casos de demencia registrados (1). La gran prevalencia de esta patología se asocia al envejecimiento progresivo de la población. Actualmente se estima un 1,1% entre los 65 y 69 años; 3,4% en los 70-74 años; 6,9% en los 75-79 años; 12,1% en los 80-84; 20,1% en los 85-89; y hasta 39,2% entre >90 años (3). En los próximos años se espera un aumento exponencial de los casos, por lo que es fundamental fomentar la investigación y el diseño de nuevas estrategias terapéuticas que mejoren la calidad de vida de las personas mayores. A pesar de que el mecanismo fisiopatológico de la EA no se conoce completamente, está demostrada su asociación con dos principales factores neurodegenerativos: la formación de placas de proteína β-amiloide (Aβ) extracelulares, y la formación de ovillos intracelulares de neurofibrillas (4). Las placas de Aβ se forman por el procesamiento alternativo de la PPA (Proteína Precursora de Amiloide). El enzima β-secretasa seguido del γ-secretasa catalizan la escisión de la PPA resultando en la formación de partículas de Aβ40 y Aβ42. Estas moléculas mal plegadas, en altas concentraciones, favorecen la formación de oligómeros solubles con propiedades neurotóxicas. Estos oligómeros a su vez tienden a precipitar, formando los característicos acúmulos de Aβ en las meninges, la materia gris e incluso los vasos del SNC (5). Por otro lado, la formación de estos ovillos de neurofibrillas se debe a la desregulación de las proteínas Tau. Las proteínas Tau son estabilizadoras de microtúbulos y por mecanismos no conocidos, tienden a hiperfosforilarse, perdiendo su función. Es entonces cuando se agregan entre sí de forma gradual hasta formar las características neurofibrillas insolubles (5). La EA presenta un amplio espectro sintomatológico. Este varía desde síntomas como desorientación, irritabilidad, agresividad o apatía hasta el desarrollo de trastornos neuropsiquiátricos como la ansiedad o la depresión (6). No obstante, el síntoma más característico de la EA es la demencia (7). En función de la sintomatología, distinguimos una primera fase asintomática (comienza a acumularse Aβ y proteínas Tau fosforiladas), una segunda fase de la EA leve (con disfunción cognitiva poco pronunciada) y la fase de la EA grave o demencia (6).
El objetivo de esta revisión es recopilar información acerca de las nuevas terapias existentes para tratar la EA y comparar su efectividad con las más usadas en la clínica. Nos centramos especialmente en el uso de anticuerpos monoclonales (AcMo) que marcan y destruyen los acúmulos de Aβ, su mecanismo de acción, sus efectos secundarios y su eficacia clínica.
2. Terapias convencionales
2.1. No farmacológicas
Algunas terapias convencionales no farmacológicas han demostrado reducir el deterioro cognitivo en pacientes con EA (8). En este aspecto existen numerosos métodos desde los que se puede tratar a los pacientes como musicoterapia, terapia de jardín, orientación de la realidad o estimulación sensitiva (8-11). Se ha encontrado en varios metaanálisis que el ejercicio físico (uno de los más investigados) tiene un impacto positivo en la prevención y la reducción de la EA (9). Se ha demostrado que el ejercicio aeróbico tiene efectos más positivos que el ejercicio anaeróbico al retrasar la aparición de síntomas de la EA (10). Se encontró que el ejercicio promueve la neurogénesis en pacientes con EA (8). Sin embargo, se requiere de mayor investigación sobre estos métodos para retrasar los síntomas de la EA, pues actualmente solo existen meras correlaciones entre estas terapias y el retraso de sus síntomas (8).
2.2. Farmacológicas
2.2.1. Inhibidores de la acetilcolinesterasa (IAChE)
Los IAChE inhiben la degradación del neurotransmisor acetilcolina (12). Esto permite compensar la disminución de acetilcolina debido a la muerte de neuronas colinérgicas en enfermedades neurodegenerativas como la EA (12). De ahí su importancia en la EA al reducir sus síntomas por este medio (12). Los tratamientos actuales con IAChE resultan adecuados para el tratamiento de la EA leve o moderada (5). Este es el mismo grupo para el que hay investigación actual con los AcMo (5). Estos medicamentos, tienen el inconveniente de presentar hepatotoxicidad, por lo que su uso se dificulta ante pacientes con hepatopatías (5). Además, los IAChE son metabolizados en el hígado por el citocromo P450, lo cual limita aún más su utilización en determinados pacientes con patologías paralelas a la EA, debido a sus posibles interacciones (5). Esto es debido a posibles interacciones con otros fármacos (5). Sin embargo, fármacos de nuevas generaciones como la galantamina han logrado reducir su hepatotoxicidad y efectos secundarios, dejando a otros más antiguos como alternativa (5).
Los IAChE han demostrado retrasar de manera eficaz la aparición de síntomas de la EA (5). Actúan aumentando los niveles del neurotransmisor acetilcolina en el cerebro mediante la inhibición de la acetilcolinesterasa (5). Este neurotransmisor es importante para funciones cognitivas como la memoria, el aprendizaje o la función cognitiva (5). Las características de la aplicación clínica de este fármaco se especifican en la Tabla 1 de este estudio.
Tabla 1. Tratamientos convencionales para la EA. Adaptado de Calabrò M, Rinaldi C. Et al (5), Rees TM, Brimijoin S (9), Song X, Jensen MØ (10)
|
Tratamientos convencionales |
Mecanismo de acción | Grado de EA para su implementación | Indicaciones clínicas | Interacciones |
| Tacrina | Inhibición de la Acetil-colinesterasa | Alzheimer leve o moderado | Se utiliza cuando el paciente no es compatible con el resto de inhibidores de la Acetil-colinesterasa | Al ser metabolizado por el citocromo P450 en el hígado puede interaccionar con otros medicamentos |
| Donezepil | Inhibición de la Acetil-colinesterasa | Alzheimer leve o moderado | Usar con precaución en pacientes con problemas hepáticos o renales severos | |
| Rivastigmina | Inhibición de la Acetil-colinesterasa | Alzheimer leve o moderado | Se administran dosis progresivamente más altas hasta 6-12 mg/día, lo máximo recomendado, pues su beneficios incrementan con la dosis | |
| Galantamina | Inhibición de la Acetil-colinesterasa | Alzheimer leve o moderado | La dosis recomendada es de 16-24 mg/día administrados con dosis progresivamente mayores desde el inicio del tratamiento con 4mg 2 veces al día | |
| Memantina | Inhibición no competitiva de los receptores de NMDA (ácido N-metil-D-aspártico). | Alzheimer moderado o avanzado | La dosis inicial recomendada es de 5 mg diarios, que se recomienda aumentar a 10 mg diarios al cabo de 4-6 semanas | No se conocen interacciones con otros fármacos. Se requiere mayor investigación. |
| Métodos no farmacológicos | Incremento de la neurogénesis mediante actividades cognitivamente estimulantes | Cualquier estadío de Alzheimer (se requiere mayor investigación) | Sin contraindicaciones. Recomendado para todos los pacientes con EA | No presenta interacciones. |
2.2.2. Bloqueadores del Ácido N-meti-D-Aspártico (antagonistas de NMDA)
Utilizados también para tratar la demencia y la EA, son inhibidores no competitivos de receptores alto-voltaje dependientes de antagonistas de NMDA (5). El receptor NMDA transduce la unión de glutamato y glicina, acoplándola a la apertura de un canal iónico permeable al calcio (13). De este modo se bloquea la permeabilidad iónica de este canal, ya que su sobrexpresión resulta citotóxica, un fenómeno habitualmente encontrado en pacientes con patologías neurodegenerativas como la demencia o la EA (13). Se ha demostrado su utilidad en el tratamiento de la EA tanto moderada como severa (5). Puede presentar ciertos efectos secundarios (5). Su solución es modificar los horarios en los que se administra este medicamento (5). No requiere un seguimiento enzimático a diferencia de los inhibidores de la IAChE (5). El principal representante de este tipo de fármacos es la memantina, cuyas características sobre su aplicación clínica se especifican en la Tabla 1 de este estudio.
3. Anticuerpos monoclonales
Los AcMo mencionados quedan resumidos en la Tabla 2.
Tabla 2. Anticuerpos monoclonales más comunes para el tratamiento de la EA
| AcMo | Mecanismo de acción | Efectos adversos graves | FDA | EMA |
| Aducanumab | Unión al extremo N-terminal de los Aβ para ser reconocido el agregado por el sistema inmune. | ARIA-E y ARIA-H (el alelo APOE ε4 aumenta las probabilidades de aparición de ARIA) | APROBADO | RETIRADO DEL MERCADO |
| Lecanemab | Llega desde el plasma al cerebro y reduce las protofibrillas solubles/solubles de Aβ | APROBADO | BAJO ESTUDIO | |
| Donanemab | Unión al extremo N-terminal de los Aβ precipitados para ser reconocido el agregado por el sistema inmune. | ARIA-E y ARIA-H (el alelo APOE ε4 aumenta las probabilidades de aparición de ARIA) y RRI | APROBADO | BAJO ESTUDIO |
| Gantenerumab | Fagocitosis mediada por microglía seguida de degradación lisosomal. | ARIA-E y ARIA-H (el alelo APOE ε4 aumenta las probabilidades de aparición de ARIA) |
FASE III DE ESTUDIO |
|
3.1. Aducanumab
Aducanumab fue el primer anticuerpo monoclonal en ser aprobado por la FDA en junio de 2021, tras su éxito en reducir los niveles de Aꞵ en pacientes con EA prematuro en dos ensayos clínicos en fase 3: EMERGE y ENGAGE. Se observaron las repercusiones que tendría el tratamiento con aducanumab en bajas y altas concentraciones (el último grupo fue tratado con placebo). En un primer lugar, se rechazaron los resultados de estos ensayos, ya que se asumió que ambos ensayos darían resultados similares (estos eran que aducanumab no retrasa el desarrollo) y que pacientes que se incorporaron más adelante a los ensayos presentarían los mismos resultados (14). En estudios post hoc se llegó a la conclusión de que se había cometido un error en los resultados de los ensayos y que un porcentaje considerable de pacientes que recibieron dosis altas de aducanumab sí habían demostrado una disminución de los agregados de Aꞵ considerable (un 31% en ENGAGE y un 48% en EMERGE) (15). El éxito de aducanumab viene explicado por su mecanismo de unión a los Aꞵ. Este AcMo es capaz de unirse al extremo N-terminal de los agregados de Aꞵ ya que, a diferencia del extremo C-terminal, la disposición tridimensional permite una unión más afín con el extremo N-terminal, al encontrarse más expuesto (16). Aun teniendo un futuro prometedor, el tratamiento con altas dosis de aducanumab demostró ser la causa de la aparición de anomalías de imagen relacionadas con los amiloides (ARIA) (17), teniendo una frecuencia de aparición del 35%. Los ARIA-E se clasifican en función del tamaño del edema. Se consideran leves cuando las regiones presentan <5 cm, moderado para regiones singulares de 5-10 cm (o varias regiones que suman <10 cm) y severo si cualquier región es de >10 cm (15). Su aparición suele estar relacionado con una reacción neuroinflamatoria descontrolada y la saturación y bloqueo de las vías de limpieza del sistema linfático (33). Las ARIA-H se clasifican en función del número de incidentes hemorrágicos. Se consideran leve entre 1-4 incidentes, moderado entre 5-9 y severo para más de 10 (15). Ocurren por la limpieza de placas de Aꞵ de las paredes vasculares, que puede causar su rotura y la consiguiente hemorragia (33). En el estudio realizado por Stephanie J. Loomis et al. de los 1691 pacientes que fueron tratados con aducanumab, 529 desarrollaron ARIA con edema (ARIA-E, un 31,3%), 324 desarrollaron ARIA hemorrágica (ARIA-H, un 19,2%). Una de las posibles causas de este elevado riesgo viene explicado por el gen APOEε4. Se observó que aquellos que presentaban homocigosis para el alelo APOEε4 mostraron mayor riesgo de desarrollar ARIA, en oposición a aquellos con heterocigosis (APOEε3/APOEε4) o los que presentaban otra variante del gen (portadores homocigóticos o heterocigóticos de APOEε2 o APOEε3) (15). Actualmente, el aducanumab ha sido retirado de la Unión Europea tras una decisión de la Agencia Europea del Medicamento (EMA) en diciembre de 2021. La EMA expresó que consideraban insuficientes las pruebas que corroboran la eficacia de aducanumab en el tratamiento de la EA prematura (18). En Estados Unidos el aducanumab sigue estando aprobado para su uso comercial.
3.2. Lecanemab
Lecanemab es una forma humanizada de IgG1 del anticuerpo murino mab158 que ha sido aprobado en Estados Unidos para el tratamiento de la EA (21), y en Europa se encuentra en revisión. Este anticuerpo está dirigido principalmente hacia los oligómeros solubles de Aꞵ, aunque también puede actuar sobre las insolubles (20). El mab158 llega desde el plasma al cerebro y reduce los oligómeros solubles de Aꞵ presentes. En ratones, la reducción de oligómeros cerebrales se reflejó en una reducción de oligómeros en el líquido cefalorraquídeo (LCR), por lo que se descubrió la utilidad del uso de oligómeros en LCR como biomarcador de la efectividad del tratamiento (22). En cuanto al riesgo de padecer ARIA, presentan un mayor riesgo aquellos que son portadores del gen de la APOEε4, especialmente los homocigotos para APOE4. Por ello, se recomienda la genotipificación de APOE para informar mejor a los pacientes candidatos a recibir lecanemab sobre su nivel de riesgo (21). Además, lecanemab se une a los oligómeros grandes con una afinidad 25 veces mayor que aducanumab y a los pequeños con una afinidad 100 veces mayor. La afinidad de lecanemab sería menor por los monómeros (20). Aunque los efectos beneficiosos de este AcMo son varios, no está libre de efectos secundarios potencialmente graves, principalmente complicaciones hemorrágicas (23), y presenta una frecuencia de ARIA-E del 10% (23).
3.3. Donanemab
Donanemab es un anticuerpo humanizado IgG1 que se aprobó en julio de 2024 por la FDA tras resultados generalmente favorables en el ensayo clínico TRAILBLAZER-ALZ (24). En Europa, se encuentra actualmente bajo estudio por parte de la EMA (25). El mecanismo de acción del Donanemab se basa en el marcaje del epítopo del piroglutamato aminoterminal del Aꞵ acumulado únicamente en forma de placas. Este marcaje desencadena la fagocitosis de las placas mediada por células de la microglía (26-27). En la fase II de TRAILBLAZER-ALZ el mantenimiento de una concentración ≥ 4,4 μg/mL de donanemab en plasma (suministrado vía intravenosa) se asoció con una reducción de acúmulos de Aꞵ respecto al grupo placebo. El efecto se incrementó conforme las concentraciones aumentaron. En la fase III de TRAILBLAZER-ALZ se confirmó la eliminación de placas de Aꞵ en los tratados con donanemab respecto al grupo placebo a través de tomografía de emisión de positrones (TEP). También se detectó la reducción del biomarcador plasmático p-tau217, asociada a la reducción de proteína Tau patológica (28). Se observó una mejora en el puntaje de \textit{Integrated Alzheimer’s Disease Rating Scale} (iADRS). El donanemab ralentizó significativamente la pérdida de habilidades funcionales y cognitivas frente al placebo. Cabe destacar que estas mejoras no se detectaron en el grupo de pacientes con un grado alto de neurodegeneración asociado a acúmulos de proteínas Tau fosforiladas (27). El tratamiento con donanemab ha mostrado también efectos adversos. Destacan las ARIA observadas en >35% de los pacientes tratados respecto al 15% del placebo, viéndose mayormente afectados los portadores del gen ApoEε4 (27). La más común fue la ARIA-E, presente en el 24% de los pacientes tratados frente a 1,9% en placebo (27). Se detectó también ARIA-H en el 19,7% frente al 7,4% del placebo (27). Las reacciones relacionadas con la infusión (RRI) se dieron en el 8,7% de los tratados con donanemab frente al 0,5% con placebo (27). Con todo lo anterior, solo aparecieron efectos secundarios graves en el 17,8% del grupo tratado con donanemab (27).
3.4. Gantenerumab
Gantenerumab se encuentra actualmente en fase III de investigación, y se requieren más estudios para garantizar su eficacia y seguridad. Gantenerumab aún no ha sido aprobado por ninguna agencia reguladora de medicamentos, debido principalmente a la falta de evidencia contundente que respalde su eficacia. Hasta la fecha, los estudios son limitados, y ninguno ha proporcionado conclusiones definitivas sobre sus beneficios terapéuticos. Los ensayos GRADUATE I y II, llevados a cabo en pacientes con EA sintomático y esporádico, no probaron una ralentización del deterioro cognitivo, a pesar de demostrar una reducción parcial de las placas de Aꞵ y efectos en ciertos biomarcadores (31). De manera similar, el posterior estudio DIAN-TU-001 obtuvo resultados similares. Aunque esta terapia muestra un potencial muy prometedor, su efectividad aún no ha sido totalmente demostrada y conlleva un riesgo significativo de ARIAs en numerosos casos (31). Su mecanismo de acción es similar al de donanemab. Este proceso facilita la eliminación de las placas de Aꞵ acumuladas en el cerebro, al disgregar los péptidos agregados y eliminar las fibrillas Aꞵ. Además, influye en biomarcadores de la EA y en la progresión de la neurodegeneración característica de esta enfermedad (30). La actividad de este AcMo ha sido analizada mediante diversas técnicas, como microscopía electrónica y de fluorescencia, así como mediante la observación de células postmortem en tejido de pacientes con EA (30). Según ciertos estudios, gantenerumab es el AcMo con la mayor afinidad conocida por los beta-amiloides agregados que se han evaluado hasta ahora (29). Este tratamiento se administra por vía subcutánea y corresponde a un anticuerpo monoclonal IgG1 específico contra Aꞵ (30). Gantenerumab muestra una mayor afinidad por las formas agregadas de Aꞵ, interfiriendo en su crecimiento. También se une a los oligómeros solubles, neutralizando su toxicidad y generando un efecto beneficioso (30). No obstante, el uso de AcMo incluido gantenerumab, se asocia con la aparición ARIA, su principal efecto adverso. Estas anomalías pueden manifestarse como edemas (ARIA-E) con una frecuencia del 30% o microhemorragias (ARIA-H).
4. Discusión
Históricamente, el tratamiento de la EA se ha centrado en contrarrestar su sintomatología principal: la demencia. Aspectos como llevar a cabo una vida social saludable y terapias basadas en el ejercicio físico y la música nos han permitido mejorar temporalmente la calidad de vida de los pacientes. El uso de ChEI y bloqueadores de NMDA también han permitido mejorar la función neuronal. No obstante, no se ha detectado ninguna mejora en cuanto al desarrollo de la EA.
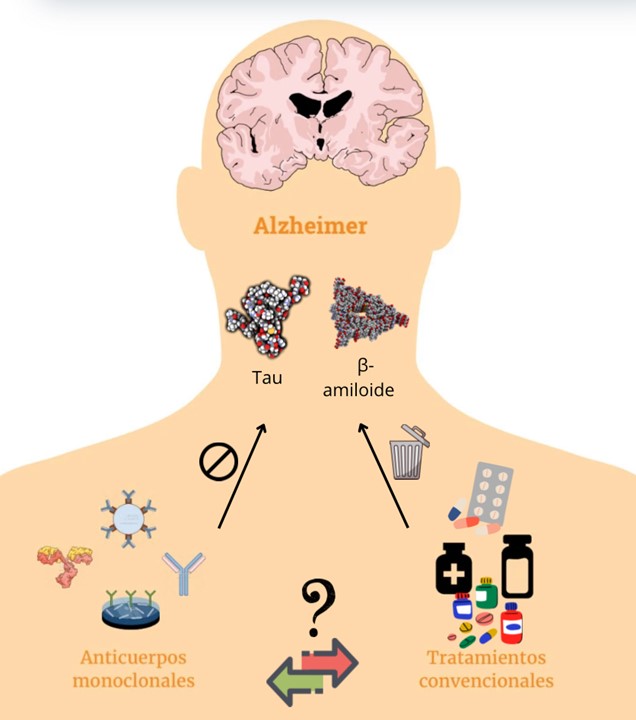
La llegada de los AcMo ha permitido, por primera vez, la posibilidad de actuar directamente sobre los mecanismos de acción conocidos EA. Esto constituye un nuevo paradigma frente a los tratamientos convencionales que buscaban únicamente paliar los síntomas (Figura 1). El tratamiento con AcMo ha demostrado ralentizar significativamente la degeneración cognitiva y neurológica a través de la eliminación de acúmulos de Aꞵ. No obstante, la falta de información sobre los efectos de los AcMo en el mecanismo fisiopatológico general de la EA ha llevado a la discrepancia entre las agencias reguladoras de medicamentos a la hora de comercializarlos. La controversia también se manifiesta en la opinión de algunos autores. Markku Kurkinen, afirma que durante el ensayo clínico TRAILBLAZER-ALZ 2 para estudiar la efectividad del Donanemab, los autores cometieron un fallo matemático. Alega que no se puede extrapolar el resultado obtenido en la iADRS a la efectividad del fármaco para reducir su desarrollo (32).
Resulta evidente la necesidad de continuar investigando los fármacos de última generación en el tratamiento de la EA. El desarrollo de nuevos AcMo podrá mejorar su efectividad contra la aparición y progresión de la EA ante la relativa inefectividad a largo plazo de los tratamientos actuales. La prevalencia de efectos secundarios como los ARIA o los RRI suponen una barrera a la hora de comercializarlos al público general. El estudio de su severidad para obtener contramedidas efectivas supone otra importante línea de investigación.
Figura 1. Vías terapéuticas posibles para el Alzheimer precoz recogidas en esta revisión.
5. Limitaciones del estudio
La RBA supone un reto cada vez mayor en el panorama médico actual, respaldando la necesidad de impulsar la investigación en este campo por lo que nuestro estudio podría suponer una fuente de información relevante. Las variables que parecen ser un factor de riesgo para la mortalidad en nuestros análisis fueron una edad avanzada y la producción de carbapenemasas. Aquellas que parecen asociadas a un mayor riesgo de infección por K. pneumoniae productora de carbapenemasas fueron una edad avanzada y proceder de Cádiz o Jaén. Se remarca la importancia de evaluar factores socioeconómicos posiblemente implicados en el aumento de incidencia de RBA, claves tanto para la prevención como para el tratamiento.
6. Conclusiones
En definitiva, una combinación de distintos tratamientos resultaría ideal para retrasar de manera más eficaz la progresión y aparición de síntomas de la EA. Destaca la combinación de métodos no farmacológicos y farmacológicos. Sin embargo, se necesita más investigación para la combinación de distintos métodos farmacológicos para descartar posibles interacciones perjudiciales. El tratamiento con AcMo resulta prometedor al intervenir de forma directa en el avance de los mecanismos fisiopatológicos conocidos de la EA. Esto constituye un avance positivo con respecto a las terapias convencionales para la EA. Sin embargo, es necesario que se lleven a cabo más estudios que confirmen una efectividad evidente de estos fármacos. Esto también se debe a la presencia de efectos secundarios como las ARIA y la falta de información de sus consecuencias a largo plazo.
Declaraciones
Conflictos de interés
Los autores no destacan ningún conflicto de interés.
Financiación
Los autores no tuvieron ninguna financiación.
Referencias
1. Ana Pérez Menéndez. Las demencias ya suponen el 8% del total de defunciones que se producen cada año en España. [Internet]. España: Sociedad Española de Neurología; 2024 [acceso 10 de marzo de 2025]. Disponible en: https://www.sen.es/saladeprensa/pdf/Link451.pdf
2. Villarejo Galende A, Eimil Ortiz M, Llamas Velasco S, Llanero Luque M, López de Silanes de Miguel C, Prieto Jurczynska C. Informe de la Fundación del Cerebro. Impacto social de la enfermedad de Alzheimer y otras demencias. Neurología. 2020;36(1):39-49.
3. Confederación Española de Asociaciones de Familiares de personas con Alzheimer y otras demencias. Censo de personas con Alzheimer y otras demencias en España. Resultados y conclusiones. España: Confederación Española de Asociaciones de Familiares de personas con Alzheimer y otras demencias [Internet]. 2022 [acceso 19 de marzo de 2025]. Disponible en: https://www.ceafa.es/files/2023/05/informe-censo-alz-2-web.pdf
4. Vaz M, Silvestre S. Alzheimer’s disease: Recent treatment strategies. Eur J Pharmacol. 2020;887:173554.
5. Calabrò M, Rinaldi C, Santoro G, Crisafulli C. The biological pathways of Alzheimer disease: a review. AIMS Neurosci. 2020;8(1):86-132.
6. Zheng Q, Wang X. Alzheimer’s disease: insights into pathology, molecular mechanisms, and therapy. Protein Cell. 2024;16(2):83-120.
7. Tarawneh R, Holtzman DM. The Clinical Problem of Symptomatic Alzheimer Disease and Mild Cognitive Impairment. Cold Spring Harb Perspect Med. 2012;2(5):a006148.
8. Quail Z, Carter MM, Wei A, Li X. Management of cognitive decline in Alzheimer’s disease using a non-pharmacological intervention program: A case report. Medicine (Baltimore). 2020;99(21):e20128.
9. López-Ortiz S, Valenzuela PL, Seisdedos MM, Morales JS, Vega T, Castillo-García A, et al. Exercise interventions in Alzheimer’s disease: A systematic review and meta-analysis of randomized controlled trials. Ageing Res Rev. 2021;72:101479.
10. Agüera Sánchez MÁ, Barbancho Ma MÁ, García-Casares N. Effect of physical exercise on Alzheimer’s disease. A systematic review. Aten Primaria. 2020;52(5):307-318.
11. Bleibel M, El Cheikh A, Sadier NS, Abou-Abbas L. The effect of music therapy on cognitive functions in patients with Alzheimer’s disease: a systematic review of randomized controlled trials. Alzheimers Res Ther. 2023;15(1):65.
12. Rees TM, Brimijoin S. The role of acetylcholinesterase in the pathogenesis of Alzheimer’s disease. Drugs Today (Barc). 2003;39(1):75-83. doi: 10.1358/dot.2003.39.1.740206. PMID: 12669110.
13. Song X, Jensen MØ, Jogini V, Stein RA, Lee CH, Mchaourab HS, Shaw DE, Gouaux E. Mechanism of NMDA receptor channel block by MK-801 and memantine. Nature. 2018;556(7702):515-519. doi: 10.1038/s41586-018-0039-9. PMID: 29670280; PMCID: PMC5962351.
14. Budd Haeberlein S, Aisen PS, Barkhof F, Chalkias S, Chen T, Cohen S, et al. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’s Disease. J Prev Alzheimers Dis. 2022;9(2):197-210.
15. Loomis SJ, Miller R, Castrillo-Viguera C, Umans K, Cheng W, O’Gorman J, et al. Genome-Wide Association Studies of ARIA From the Aducanumab Phase 3 ENGAGE and EMERGE Studies. Neurology. 2024;102(3):e207919.
16. Lu D, Dou F, Gao J. Development of amyloid beta-directed antibodies against Alzheimer’s disease: Twists and turns. Drug Discov Ther. 2023;17(6):440-4.
17. Cummings J, Aisen P, Apostolova LG, Atri A, Salloway S, Weiner M. Aducanumab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2021;8(4):398-410.
18. Agencia Europea del Medicamento. Withdrawal of application for the marketing authorisation of Aduhelm (aducanumab); 2021. Disponible en: https://www.ema.europa.eu/en/documents/withdrawal-report/withdrawal-assessment-report-aduhelm_en.pdf
19. Chowdhury S, Chowdhury NS. Novel anti-amyloid-beta (Aβ) monoclonal antibody lecanemab for Alzheimer’s disease: A systematic review. Int J Immunopathol Pharmacol. 2023;37:03946320231209839.
20. Cummings J, Apostolova L, Rabinovici GD, Atri A, Aisen P, Greenberg S, et al. Lecanemab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2023;10(3):362-77.
21. Tucker S, Möller C, Tegerstedt K, Lord A, Laudon H, Sjödahl J, et al. The murine version of BAN2401 (mAb158) selectively reduces amyloid-β protofibrils in brain and cerebrospinal fluid of tg-ArcSwe mice. J Alzheimers Dis. 2015;43(2):575-88.
22. Pérez-Martínez DA. Lecanemab en la enfermedad de Alzheimer: ¿realmente estamos ante un cambio en el pronóstico de la enfermedad? Rev Neurol. 2023;76(6):185-8.
23. Söderberg L, Johannesson M, Nygren P, Laudon H, Eriksson F, Osswald G, et al. Lecanemab, Aducanumab, and Gantenerumab — Binding Profiles to Different Forms of Amyloid-Beta Might Explain Efficacy and Side Effects in Clinical Trials for Alzheimer’s Disease. Neurotherapeutics. 2023;20(1):195-206.
24. FDA. Research Center for Drug Evaluation and. FDA approves treatment for adults with Alzheimer’s disease. FDA [Internet]. 2024 [acceso 19 de marzo de 2025]. Disponible en: https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-treatment-adults-alzheimers-disease
25. Agencia Europea del Medicamento. Alzheimer’s disease EU-IN Horizon Scanning Report. [Internet]. 2024 [acceso 19 de marzo de 2025]. Disponible en: https://www.ema.europa.eu/en/documents/report/alzheimers-disease-eu-horizon-scanning-report_en.pdf
26. Lowe SL, Willis BA, Hawdon A, Natanegara F, Chua L, Foster J, et al. Donanemab (LY3002813) dose-escalation study in Alzheimer’s disease. Alzheimers Dement (N Y). 2021;7(1):e12112.
27. Sims JR, Zimmer JA, Evans CD, Lu M, Ardayfio P, Sparks J, et al. Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial. JAMA. 2023;330(6):512-27.
28. Kang C. Donanemab: First Approval. Drugs. 2024;84(10):1313-8.
29. Bateman RJ, Smith J, Donohue MC, Delmar P, Abbas R, Salloway S, et al. Two Phase 3 Trials of Gantenerumab in Early Alzheimer’s Disease. N Engl J Med. 2023;389(20):1862-76.
30. Bateman RJ, Cummings J, Schobel S, Salloway S, Vellas B, Boada M, et al. Gantenerumab: an anti-amyloid monoclonal antibody with potential disease-modifying effects in early Alzheimer’s disease. Alzheimers Res Ther. 2022;14(1):178.
31. Bateman RJ, Li Y, McDade EM, Llibre-Guerra JJ, Clifford DB, Atri A, et al. Safety and efficacy of long-term gantenerumab treatment in dominantly inherited Alzheimer’s disease: an open label extension of the phase 2/3 multicentre, randomised, double-blind, placebo-controlled platform DIAN-TU Trial. MedRxiv Prepr Serv Health Sci. 2025;2024.10.29.24316289.
32. Kurkinen M. Donanemab: Not two without a third. Adv Clin Exp Med. 2023;32(10):1085-7.
33. Withington CG, Turner RS. Amyloid-Related Imaging Abnormalities With Anti-amyloid Antibodies for the Treatment of Dementia Due to Alzheimer’s Disease. Front Neurol. 2022;13:862369.
AMU 2025. Volumen 7, Número 1
Fecha de recepción: 18/02/2025
Fecha de revisión: 26/02/2025
Fecha de aceptación: 15/04/2025
Cita el artículo: Caravaca-Cabo P, Cepero-Alcántara G, Portillo-Medina C, Gómez-Valero Ó, Nasi-García L. Tratamiento de la Enfermedad de Alzheimer con Anticuerpos Monoclonales frente a terapias convencionales. Una revisión narrativa. AMU. 2025;7(1):28-35.
URI: https://hdl.handle.net/10481/105370
